Алексей Данилов
Андрей Данилов
Алексей Данилов
Андрей Данилов
Вы держите в руках издание первого отечественного руководства, посвящённого рассмотрению проблемы боли с позиций мультифакториального подхода. В монографии представлена биопсихосоциальная концепция боли, согласно которой при оценке и лечении пациентов с хронической болью важно учитывать роль как биологических, так и психологических, и социальных факторов. Рассмотрены современные представления о типах и патофизиологических механизмах боли, клинические и нейрофизиологические методы исследования боли, принципы и рекомендации по современной нелекарственной и фармакологической терапии боли. Изложены подходы и техники, позволяющие повысить эффективность лечения пациентов, страдающих от боли. Обсуждены вопросы перспектив развития «медицины боли». Книга предназначена для неврологов, терапевтов, анестезиологов, психиатров, психологов и других медицинских работников, участвующих в лечении пациентов с хронической болью. В этом издании появилась дополнительная, свежая информация о новых технологиях и подходах к управлению болью: биорегуляторных методах лечения, ксенонотерапии, нуклеотидах.
Авторы:
Данилов Андрей Борисович — доктор медицинских наук, профессор кафедры нервных болезней ИПО Первого МГМУ им И.М. Сеченова
Данилов Алексей Борисович — доктор медицинских наук, профессор кафедры нервных болезней ИПО Первого МГМУ им И.М. Сеченова
Рецензенты:
Голубев Валерий Леонидович — доктор медицинских наук, профессор, зав. кафедрой нервных болезней ФППОВ Первого МГУ имени И.М. Сеченова; Амелин Александр Витальевич — доктор медицинских наук, профессор кафедры неврологии Санкт-Петербургского государственного медицинского университета имени И. П. Павлова, зав. лабораторией нейрофизиологии и фармакологии боли института фармакологии имени А. В. Вальдмана.
Все права защищены. Охраняется законом РФ об авторском праве. Воспроизведение всей книги или ее части в любом виде воспрещается без письменного разрешения правообладателя.
Глава 1. Биопсихосоциокультурная модель и хроническая боль7
Глава 2. Биологические факторы и боль20
2.1. Типы и патофизиологические механизмы боли20
2.2. Периферические механизмы боли35
2.3. Центральная сенситизация: значимость для клинической практики43
2.4. Церебральные системы контроля боли61
2.5. Боль и сон75
2.6. Боль и генетика81
Глава 3. Психологические факторы и боль85
3.1. Депрессия и хроническая боль88
3.2. Тревога, страх и боль95
3.3. Когнитивные факторы и боль104
3.4. Психологические установки и боль116
3.5. Копинг-стратегии120
Глава 4. Социокультурные факторы131
4.1. Болевое поведение131
4.2. Особенности боли у мужчин и женщин137
4.3. Плацебо и ноцебо143
4.4. Религия и боль162
4.5. Страдание и хроническая боль171
Глава 5. Переход острой боли в хроническую181
Глава 6. Методы исследования боли191
Глава 7. Особенности диагностики и лечения болевых синдромов233
7.1. Мигрень233
7.2. Боль в спине: диагностика и лечение боли в нижней части спины с точки зрения доказательной медицины248
7.3. Кардиалгии263
7.4. Абдоминалгии274
7.5. Нейропатическая боль281
7.6. Комплексный регионарный болевой синдром295
7.7. Фибромиалгия312
7.8. Хроническая тазовая боль329
7.9. Болевой синдром при болезни Фабри345
7.10. Соматоформные болевые расстройства358
Глава 8. Фармакотерапия боли372
8.1. Парацетамол (ацетоминофен)372
8.5. Активаторы калиевых каналов411
8.10. Пластырь с капсаицином442
Глава 9. Нелекарственные методы лечения боли474
9.1. Когнитивно-поведенческая терапия474
9.2. Лечение оперантным научением484
9.3. Гипноз492
9.4. Кинезиотерапия501
9.5. Технология адаптивного биоуправления515
9.6. Ксенонотерапия521
9.7. Чрескожная электронейростимуляция (ЧЭНС)526
9.8. Лечебная физкультура528
9.9. Снежный мир. Виртуальная реальность549
Глава 11. Боль в спине: смена концепции лечения567
Глава 12. Способы повышения эффективности лечения боли594
12.1. Мультидисциплинарные программы594
12.2. Повышение мотивации к переменам при лечении хронической боли599
12.3. Работа с семьями пациентов с хронической болью610
12.4. Работа с пациентами по применению лекарств622
Глава 13. Медицина боли: настоящее и будущее629
Эту книгу мы хотим посвятить
нашим любимым учителям:
Александру Моисеевичу Вейну
и Валерию Леонидовичу Голубеву
Французский философ Этьен Жильсон говорил, что «чем далее мы продвигаемся в глубину изучаемого объекта, тем сложнее становится дальнейшее продвижение». В последние годы мы видим значительный прогресс в представлениях о патофизиологических механизмах боли: разработаны новые диагностические методики и инновационные методы терапии, однако лечение пациентов до сих пор остается серьезной проблемой. Мы хорошо понимаем, что хроническая боль — это состояние, при котором больной не только стресс испытывает, но сталкивается с множеством других повседневных трудностей, влияющих на все аспекты его жизни. Хроническая боль истощает эмоциональные ресурсы человека, приводя к ощущению беспомощности, безнадежности и в конечном итоге — к депрессии и социальной дезадаптации. Также совершенно очевидно, что для общества непрекращающаяся боль является бременем, связанным с огромными затратами на медицинское обслуживание, льготами для инвалидов, потерей производительности. Тем не менее проводимое лечение остается малоэффективным и число пациентов с хроническими болевыми синдромами неуклонно увеличивается. Почему это происходит?
Во многом это обусловлено доминированием на протяжении многих десятилетий так называемой биомедицинской модели болезни, согласно которой боль является, как правило, прямым отражением органического заболевания или повреждения. Наш любимый учитель Александр Моисеевич Вейн был одним из первых, кто с
Однако только в последнее десятилетие была разработана биопсихосоциальная концепция боли, позволяющая учесть весь комплекс явлений, приводящих к развитию хронической боли, и определить пути наиболее эффективной терапии. В соответствии с этой концепцией боль представляет собой результат динамического взаимодействия биологических, психологических и социокультурных факторов (Turk D.С., 2001). На разных стадиях прогрессирования заболевания их «удельный вес» может изменяться. Так, в острую фазу преобладают биологические ноцицептивные процессы, но с течением времени на первый план выходят патофизиологические механизмы, обусловленные действием психологических и социальных факторов. В связи с этим лечение хронической боли, направленное только на физический компонент, часто оказывается неэффективным. Научные исследования последних двух десятилетий убедительно продемонстрировали ключевую роль именно психосоциальных факторов в развитии хронической боли и эффективность применения биопсихосоциального подхода в ее лечении. Поэтому для достижения успеха необходимо воздействовать не только на физиологические процессы, что, безусловно, очень важно, но и на когнитивные, эмоциональные и поведенческие нарушения, связанные с хронической болью.
В предлагаемой книге мы сделали попытку рассказать о биопсихосоциальной модели хронической боли и ее значении для клинической практики. Будем рады, если книга окажется полезной и поможет взглянуть на проблему боли с новых позиций.
Андрей Данилов,
Алексей Данилов

Представленный на отечественном рынке препарат Эторелекс® является классическим представителем группы лекарственных средств селективного ингибирования ЦОГ-2.
Препарат оказывает противовоспалительный и противоболевой эффекты при относительно невысоком риске гастроинтестинальных, сердечно-сосудистых, нефротоксических и гепатотоксических событий [3].
Подобрать терапию для пациента со скелетно-мышечной болью бывает весьма проблематично, так как важно обращать внимание на низкий риск развития нежелательных эффектов со стороны ЖКТ и ССС, на эффективность НПВП в отношении снятия боли и воспаления и длительность этого эффекта.
Реклама. АО "Фармасинтез", ИНН: 3810023308, ERID: LdtCKAdDe
«За развитие отечественного сегмента НПВС», XXII Премии «Платиновая унция»
Эторелекс®, как представитель класса коксибов, можно рассматривать как препарат выбора для лечения пациентов с острой, подострой, а также с хронической скелетно-мышечной болью поскольку он обладает низким риском развития нежелательных эффектов в отношении ЖКТ и минимальным риском развития протромботических событий, что успешно подтверждено данными приведенных мета-анализов.
Показан для лечения боли и воспаления при:
«Боль в спине на амбулаторном приеме»
Камчатнов Павел Рудольфович — доктор медицинских наук, профессор кафедры неврологии, нейрохирургии и медицинской генетики лечебного факультета РНИМУ им. Н.И. Пирогова, г. Москва
Подбор безопасной терапии при различных болевых синдромах скелетно-мышечного происхождения всегда актуальная тема для практикующего невролога и ревматолога.
Для купирования болевого синдрома широко применяются НПВП, при назначении которых необходимо учитывать факторы риска развития побочных эффектов, особенно у лиц пожилого и старческого возраста [2].
Спектр нежелательных явлений, связанных с данной группой препаратов, обусловлен прежде всего поражением сердечно-сосудистой системы (ССС), желудочно-кишечного тракта (ЖКТ), почек и печени (рис. 1).
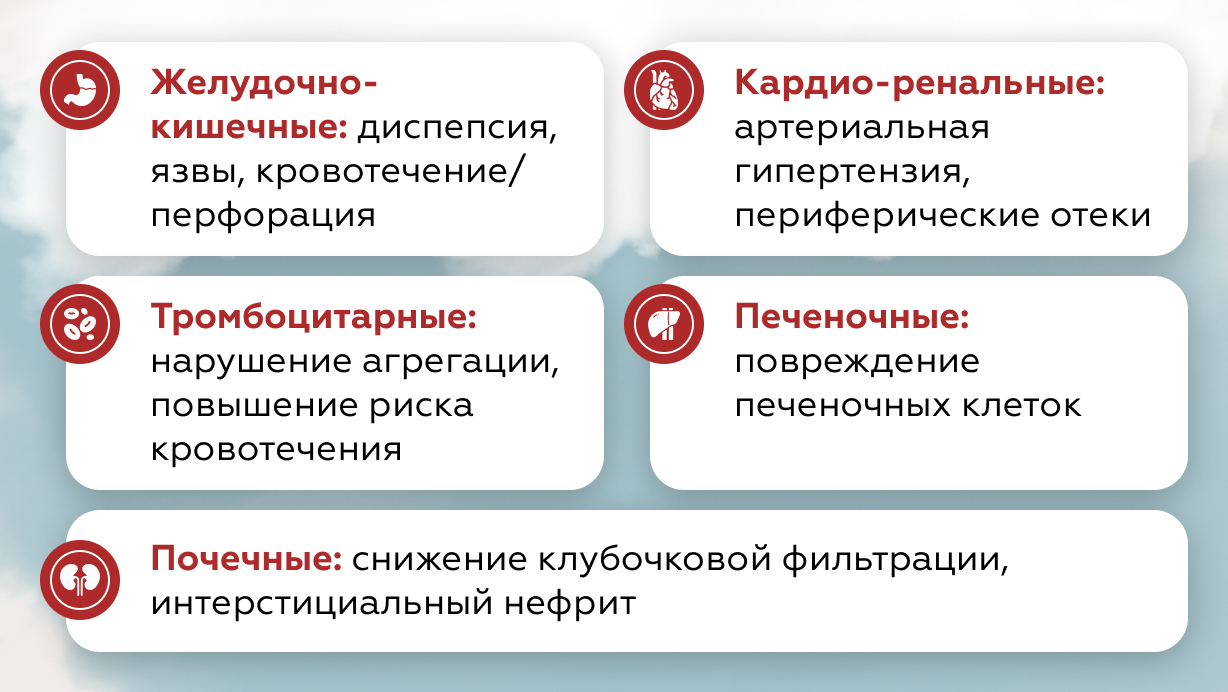
Также, необходимо принимать во внимание различия механизма действия НПВП — различная тропность к двум видам циклооксигеназы (ЦОГ) существенно отличает препараты данной группы друг от друга с точки зрения безопасности [1].
80% пациентов пожилого возраста страдают болевым синдромом, вследствие наличия заболеваний суставов и позвоночника, что существенно сказывается на их качестве жизни
Данные пациенты часто имеют полиморбидность и нередко страдают от полипрагмазии. Поэтому, более пристальное внимание у них уделяется вопросам безопасности и правильного использования НПВП [2].
Соотношение активности НПВП в блокировании ЦОГ-1 и ЦОГ-2 позволяет судить об их потенциальной токсичности и чем селективнее НПВП блокируют ЦОГ-2 по сравнению с ЦОГ-1, тем безопаснее считается препарат (рис.2).

В клинико-фармакологических исследованиях, среди всех НПВП, самые высокие показатели среди всех коксибов у Эторикоксиба. Этот фактор определяет клиническую безопасность препарата [3].
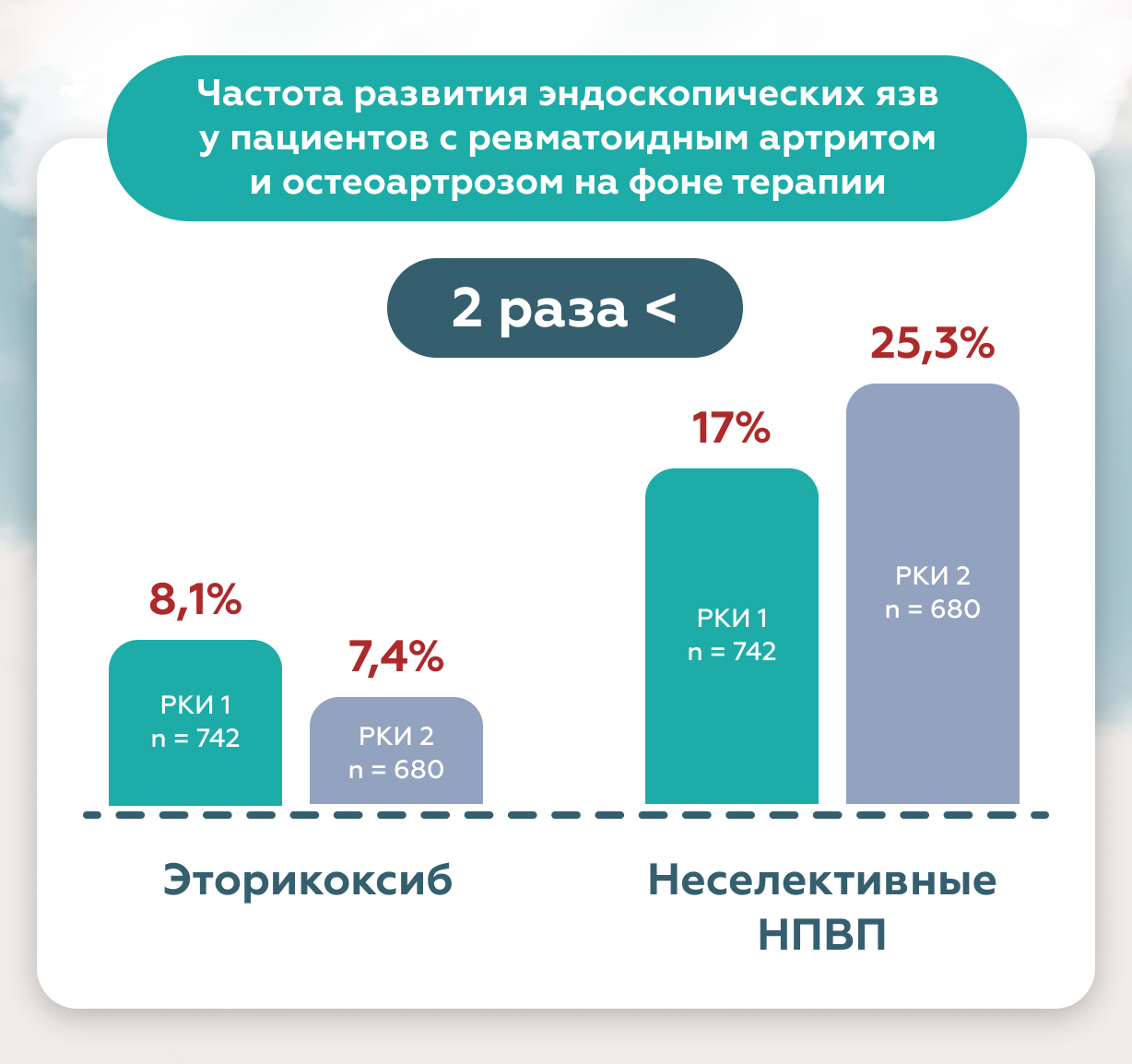
Дополнительным и несомненным преимуществом коксибов, является относительно невысокий риск поражения слизистой верхних отделов желудочно-кишечного тракта, что подтверждено мета-анализом большого числа рандомизированных клинических исследований.
Так, в 2 масштабных
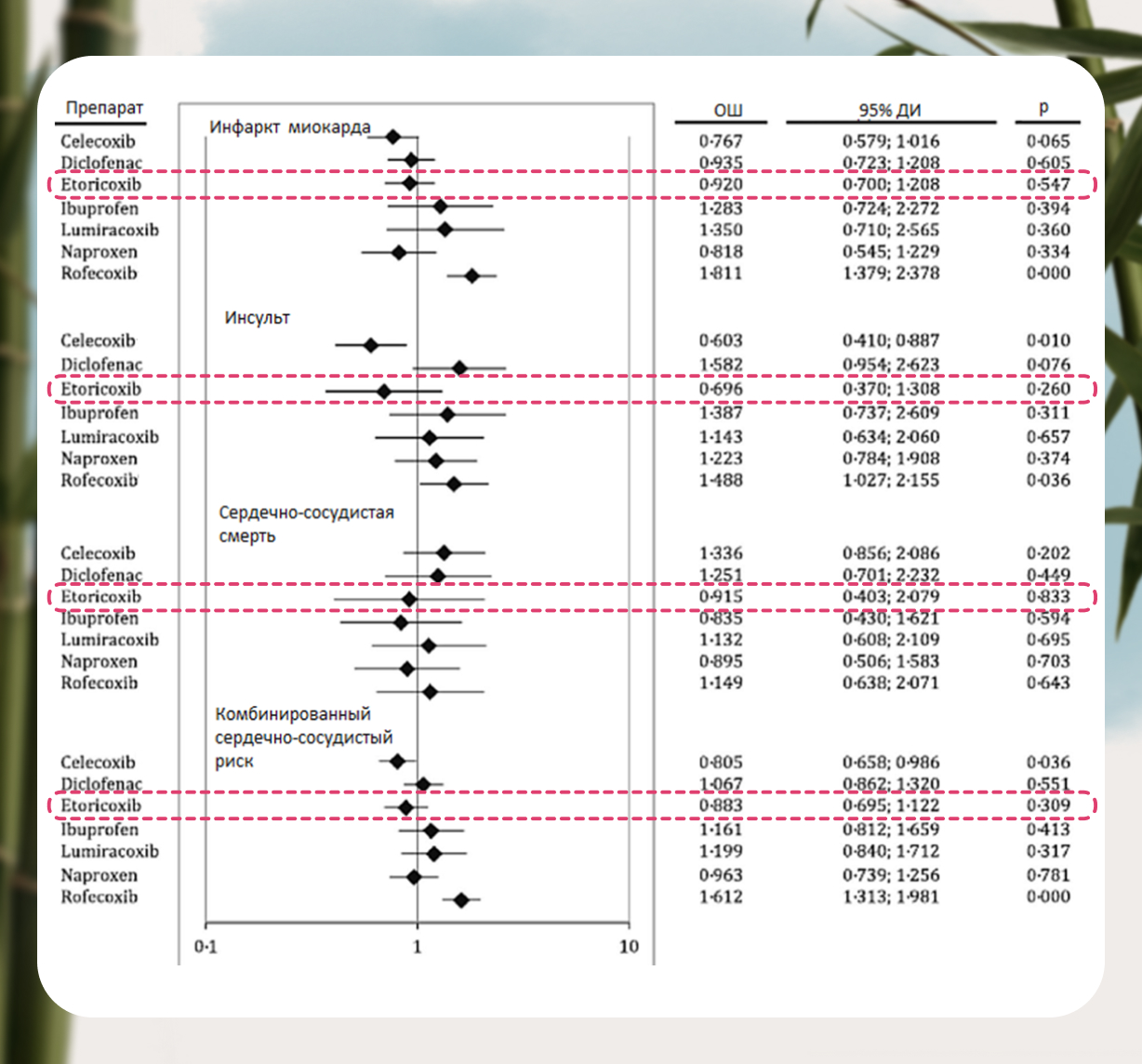
Что касается кардиобезопасности, то на сегодняшний день убедительно показано, что при использовании терапевтических доз НПВП вероятность развития острого коронарного тромбоза или тромбоза другой локализации у селективных ингибиторов ЦОГ-2 не отличается от таковых неселективных ингибиторов [5] (рис.4).
Тем не менее, серьезной проблемой является лечение пожилого пациента, у которого имеется застойность сердечной недостаточности, другие системные поражения и заболевания. В данной ситуации, применение НПВП не должно вызывать изменений течения фоновой патологии.
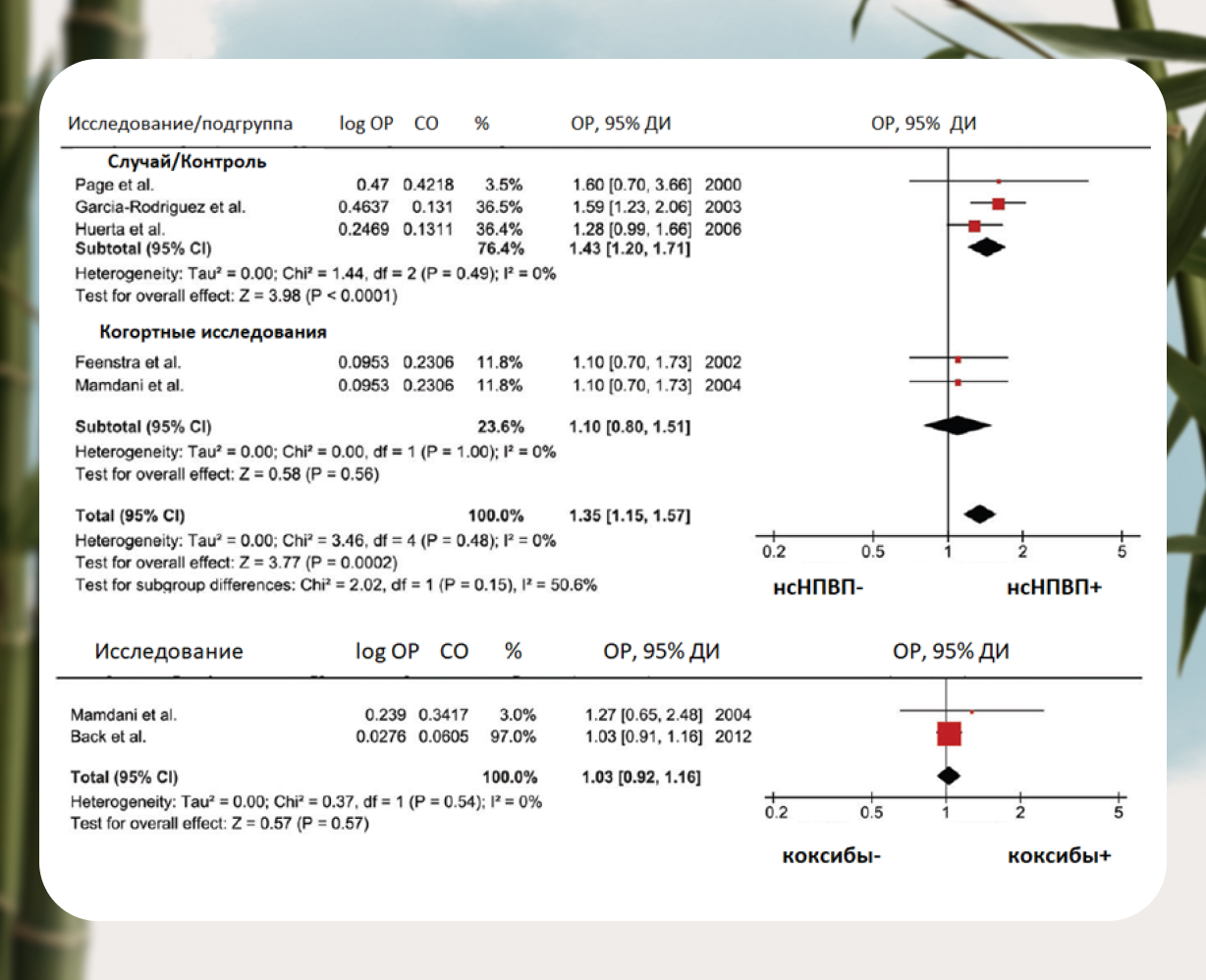
На примере 7 исследований (4 — «случайный/контроль», 3 — когортных, с участием 7,7 млн. пациентов) по оценке возникновения рисков сердечно-сосудистых осложнений (ССО) при приеме НПВП, продемонстрировано, что использование селективных ингибиторов ЦОГ — 2, а именно коксибов, ни в коем случае не повышают риск развития сердечной недостаточности или изменения состояния данных пациентов, что особенно актуально для пациентов старшей возрастной группы [7] (рис.5).
Отдельно изучался вопрос о рисках развития острого ишемического инсульта на фоне приема НПВП, так как имеются данные, что некоторые препараты повышают такой риск: Европа, 6 стран, 49 тыс. случаев ишемического инсульта (ИИ) среди 4,6 млн. потребителей НПВП. Однако и здесь коксибы продемонстрировали низкую вероятность развития ишемического инсульта [8] (рис.6).
Фармакотерапия хронической боли занимает существенное ме-сто в концепции биопсихосоциального подхода. Знание врачами групп препаратов для лечения боли, особенностей механизма их действия является очевидным для успешной клинической практики. Одна из проблем, в первую очередь для пациентов — полипрагмазия. Вследствие клинической сложности болевых синдромов пациенты получают много различных фармацевтических препаратов, однако при этом зачастую отсутствует адекватный контроль за их применением со стороны врачей. Другая проблема — применение стандартных НПВП терапии для разных типов боли. Например, так-тика и стратегия использования НПВП в неврологической практике отличаются от таковых при лечении ревматологической боли.
В терапии пациентов с хронической болью очень важна согласованность действий между врачами различных специальностей, чего можно добиться только с помощью регулярного общения. Обсуждая клинические и поведенческие результаты, важно сообща проводить их оценку и совместно планировать и корректировать лечение. При этом для каждого пациента необходимо определить место и потенциал фармакотерапии в комплексной биопсихосоциальной модели лечения.
В этой главе рассмотрены основные группы фармакологических средств, используемых сегодня в терапии болевых синдромов.
Парацетамол — один из самых популярных анальгетиков в мире. Он был синтезирован в Германии, причем раньше, чем ацетилсалициловая кислота — еще в 1873 г. (Morse M.) и испытан как жаропонижающее лекарство в 1894 г. Однако на фармакологическом рынке парацетамол появился лишь спустя более чем полвека — в 1950 г. в США в составе комбинированного обезболивающего сред-ства. Как самостоятельный препарат он увидел свет через 5 лет (1955) быстро завоевал симпатию врачей и пациентов по всему миру.
После десятилетий применения в клинике механизм антиноцицептивного эффекта парацетамола до сих пор остается не до конца понятным.
Ингибирование синтеза простагландинов — по-прежнему наиболее распространенная гипотеза его механизма действия. Тем не менее становится очевидным, что он не единственный. На собаках, к примеру, было установлено, что изоформа циклооксигеназы ЦОГ-3 необходима для синтеза простагландинов и ингибируется парацетамолом, но это не относится к грызунам и человеку. На основе экспериментальных исследований на животных было высказано предположение, что антиноцицептивный эффект парацетамола может быть по крайней мере частично опосредован через активацию серотонинергического антиноцицептивного пути на уровне головного или спинного мозга. Значимость этого механизма, расположение и конкретизация субтипов
Парацетамол обладает умеренной анальгетической активностью, однако редко вызывает нежелательные эффекты. Это позволило ассоциациям ревматологов Европы (EULAR) и США (ACR) рекомендовать парацетамол как препарат «первой линии» для симптоматической терапии ряда ревматических заболеваний, прежде всего остеоартроза. Однако он существенно уступает по своей эффективности НПВП и в нашей стране для лечения ревматических болезней используется достаточно редко (обычно в качестве дополнительного анальгетика или при наличии серьезных противопоказаний к назначению НПВП).
Парацетамол показан при мышечно-скелетной боли слабой и умерен-ной выраженности, мигрени, зубной боли, альгодисменореи, постопреационной боли, остеоартрозе.
Парацетамол не является «конкурентом» НПВП или опиоидов. Наиболее рационально воспринимать этот препарат в качестве не-обходимой составной части комплексной противоболевой терапии. Ведь механизм его действия отличается от других анальгетиков, а значит, их комбинированное использование в сравнении с моно-терапией должно обеспечивать больший терапевтический успех. Это доказывает опыт применения комбинации парацетамола с опиоидными анальгетиками или НПВП при зубной боли, постоперационной боли и при остеоартрозе. При остеоартрозе такая терапия позволяет не только усилить лечебное действие, но и снизить дозу НПВП. Это очень важно с точки зрения снижения риска лекарственных осложнений, т.к. есть прямая зависимость между дозой НПВП и часто-той развития серьезных побочных эффектов.
Для взрослых и подростков старше 12 лет (масса тела более 40 кг) максимальная разовая доза парацетамола — 1 г, максимальная су-точная доза — 4 г. Для детей максимальная разовая доза —
В последние годы появились данные о гепатотоксическом действии парацетамола при его умеренной передозировке, при назначении парацетамола в высоких терапевтических дозах и одновременном приеме алкоголя или индукторов микросомальной ферментной системы печени Р-450 (антигистаминные препараты, глюкокортикоиды, фенобарбитал, этакриновая кислота). Однако при использовании терапевтических доз парацетамола (до 4 г/сут) вероятность развития серьезных побочных эффектов со стороны печени и почек представляется достаточно низкой. Даже у больных с циррозом печени и алкоголизмом по данным ряда серьезных клинических исследований (вопреки распространенному в России мнению) парацетамол переносится достаточно хорошо и не вызывает опасных осложнений. Аналогичная ситуация отмечается и при использовании парацетамола у пациентов с почечной патологией. Конечно, у больных с серьезными коморбидными заболеваниями любая анальгетическая терапия должна проводиться с большой осторожностью, однако в плане безопасности парацетамол представляется в этой ситуации несомненным препаратом выбора.
В целом этот класс препаратов отличают высокая безопасность хорошая переносимость. У НПВП отсутствует нежелательное воздействие на психические функции (развитие сонливости, снижение скорости реакции и пр.). В отличие от опиоидов нет проблемы развития лекарственной зависимости. Однако вследствие широкого назначения врачами, а также безрецептурного отпуска НПВП занимают лидирующее место среди причин нежелательных последствий фармакотерапии (гастро — энтерологические, кардио — васкулярные и аллергические нарушения). Нежелательные действия препаратов клинически значимы даже в том случае, если они не являются угрожающими для жизни и здоровья пациента, поскольку плохая переносимость фаркамотерапии приводит к снижению приверженности к лечению.
Фактор приверженности к лечению нередко упускают из виду при проведении клинических исследований и составлении рекомендаций, делая основной смысловой акцент на эффективности препарата. Между тем результаты лечения определяются как эффективностью применяемого средства, так и приверженностью больных к лечению. Установлено, что половина пациентов, которым назначают препараты для постоянного приема, через три месяца самостоятельно прекращают назначенное лечение, в большинстве случаев — из-за побочных эффектов терапии.
В 1971 г. группа исследователей из Великобритании во главе с J. Vane открыли основной механизм действия НПВП, связанный с ингибицией активности циклооксигеназы (ЦОГ) — ключевого фермента метаболизма арахидоновой кислоты, предшественника простагландинов (ПГ).
Было показано, что именно антипростагландиновая активность НПВП лежит в основе их противовоспалительного, жаропонижающего анальгетического действия. В
Это создало предпосылки для создания нового класса НПВП, обладающих способностью селективно ингибировать ЦОГ-2, применение которых может сделать лечение эти-ми препаратами более безопасным.
В болеутоляющем действии НПВП не исключен и центральный механизм. Он связан с угнетением синтеза ПГ, которые образуются в ЦНС. Спустя несколько часов после локализованного периферического повреждения ткани ЦОГ-2 начинает ускоренно синтезироваться в нейронах ЦНС. В результате повышается уровень простагландина Е2, обладающего пресинаптическим и постсинаптическим действием, облегчающим синаптическую трансмиссию и повышающим возбудимость нейрона.
В то же время ПГ негативно влияют на физиологический механизм нисходящей ингибиции.
В целом это способствует развитию центральной сенситизации, одного из механизмов хронификации боли. Кроме того, распространение центральной индукции ЦОГ-2 способствует генерализации боли, нарушению аппетита, сна, снижению фона настроения — симптомов, характерных для воспалительных заболеваний. Следовательно, ингибирование центральной индукции ЦОГ-2 может рассматриваться как значимый компонент анальгетической активности НПВП.
Представители широкого класса НПВП различаются как по фармакокинетическим, фармакодинамическим параметрам, так и по отношению к ингибированию ЦОГ-1 и ЦОГ-2 (табл. 1 и 2). Сегодня общепринятым является положение о том, что эффективность всех НПВП в отношении уменьшения боли примерно одинакова, а степень безопасности определяется их отношением к ферментам ЦОГ-1 и ЦОГ-2.
Так, большая селективность НПВП в отношении ЦОГ-1 ассоциирована с риском желудочно-кишечных осложнений, а селективность в отношении ЦОГ-2 — с риском кардио — васкулярных нежелательных явлений.
| I. Производные кислот | |
| Арилкарбоновые кислоты | |
| Салициловая кислота | аспирин дифлунисал трисалицилат бенорилат салицилат натрия |
| Антраниловая кислота (фенаматы) | флуфенамовая кислота мефенамовая кислота меклофенамовая кислота |
| Арилалкановые кислоты | |
| Арилуксусная кислота | диклофенак фенклофенак алклофенак фентиазак |
| Гетероарилуксусная кислота | толметин зомепирак клоперак кеторолак триметамин |
| Индол/инденуксусные кислоты | индометацин сулиндак этодолак ацеметацин |
| Арилпропионовая кислота | ибупрофен флурбипрофен кетопрофен напроксен оксапрозин фенопрофен фенбуфен супрофен индопрофен тиапрофеновая кислота беноксапрофен пирпрофен |
| Эноликовая кислота | |
| Пиразолидиндионы | фенилбутазон оксифенилбутазон азапропазон фепразон |
| Оксикамы | лорноксикам пироксикам изоксикам судоксикам мелоксикам |
| II. Некислотные производные | |
| проквазон тиарамид буфексамак эпиразол набуметон флюрпроквазон флуфизон тиноридин колхицин |
|
| III. Комбинированные препараты | |
| артротек (диклофенак + мизопростол) | |
| Степень селективности к ЦОГ-1 или ЦОГ-2 | Название препарата |
| Выраженная селективность в отношении ЦОГ-1 | Ацетилсалициловая кислота Индометацин Кетопрофен Пироксикам |
| Умеренная селективность в отношении ЦОГ-1 | Диклофенак Ибупрофен Напроксен и др. |
| Примерно равноценное ингибирование ЦОГ-1 и ЦОГ-2 | Лорноксикам |
| Умеренная селективность в отношении ЦОГ-2 | Мелоксикам Нимесулид Набуметон |
| Выраженная селективность в отношении ЦОГ-2 | Эторикоксиб Целекоксиб Вальдекоксиб Рофекоксиб |
Некоторые НПВП могут назначаться один раз в день, что намного удобнее при необходимости длительного лечения. Поскольку НПВП об- ладают «эффектом потолка», увеличение дозы после определенного по- рогового значения не усиливает обезболивающего эффекта, хотя может увеличить его продолжительность (табл. 3).
| Группа/лекарственный препарат | Доза (мг) | Кратность приема | Максимальная суточная доза (мг) |
| Производные пропионовой кислоты | |||
| Фенопрофен | 3200 | ||
| Флурбипрофен | 100 | 300 | |
| Ибупрофен | 3200 | ||
| Кетопрофен | 300 | ||
| Напроксен натрия | 1375 | ||
| Напроксен | 1500 | ||
| Оксапрозин | 1200 | ||
| Кеторолак | 10 | 40 | |
| Производные уксусной кислоты | |||
| Диклофенак | 200 | ||
| Этодолак | 1200 | ||
| Индометацин | 200 | ||
| Сулиндак | 200 | 2 | 400 |
| Толметин | 2000 | ||
| Фенаматы (производные аминобензойной кислоты) | |||
| Меклофенамат | 400 | ||
| Мефенаминовая кислота | 250 | 4 | 100 |
| Оксикамы | |||
| Лорноксикам | 2 | 16 | |
| Пироксикам | 20 | ||
| Мелоксикам | 7,5 | 1 | 15 |
| Производные салициловой кислоты | |||
| Сальсалат | 2 | 1500 | |
| Дифлунисал | 2 | 1000 | |
| Трисалицилат | 2 | 3000 | |
| Нафтилалконы | |||
| Набуметон | 1500 | ||
| Коксибы | |||
| Целекоксиб | 800 | ||
| Рофекоксиб | 50 | ||
| Эторикоксиб | 1 | 120 | |
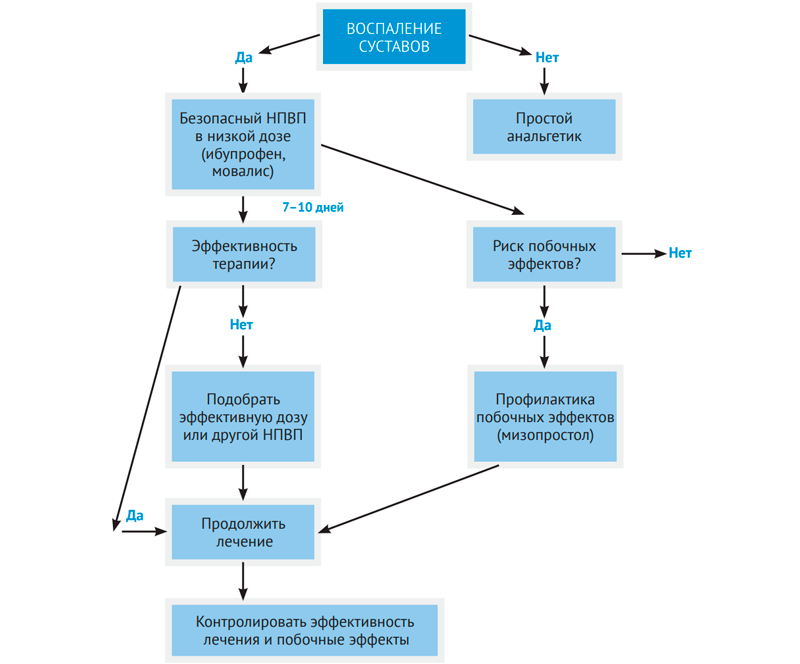
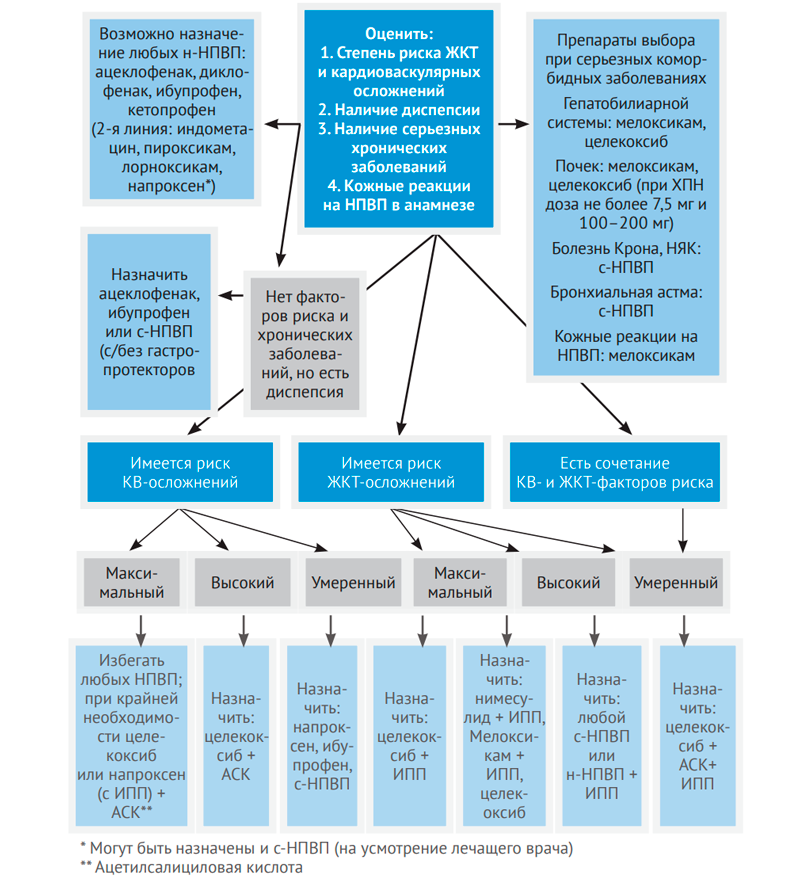
Вопросы применения НПВП в ревматологической практике освещаются регулярно в специальной литературе. Главным отличием является необходимость длительного их приема пациентами, поэтому наиважнейшим является вопрос выбора безопасного препарата. На рис. 1 и 2 представлены алгоритмы применения НПВП в ревматоло-гической практике (Насонов Е.Л., Каратеев А.Е.).
В неврологической практике НПВП чаще всего используют для лечения острой боли при мигрени, ГБН, миофасциальных и мышечно-тонических синдромах, радикулопатии, фасеточной артропатии, дисфункции крестцово-подвздошного сочленения, туннельных синдромах.
Поскольку вышеуказанные болевые синдромы относятся в основном к ноцицептивному типу боли и обусловлены различными механизмами воспаления в периферических тканях, поэтому именно НПВП являются приоритетными препаратами для фармакотерапии. Однако существенными отличиями применения НПВП в неврологической практике являются их своевременное назначение и краткосрочность. В отличие от терапии ревматологических пациентов, где НПВП используют месяцами и годами, при лечении острой боли нет необходимости проводить длительные курсы НПВП-терапии. Главными задачами являются как можно более быстрое купирование острой боли, уменьшение тревоги и восстановление функции за счет плавного внедрения продуманной программы психологической поддержки и физической активности.
Чем раньше начато лечение и быстрее достигнут значимый анальгетический эффект, тем меньше вероятность хронизации боли и лучше общий прогноз. Известно, что непрекращающаяся перферическая ноцицепция может привести к формированию вторичной гипералгезии, центральной сенситизации, способствующих хронизации боли. Дальнейшее ее персистирование нередко происходит при участии психосоциальных факторов (тревога, депрессия, катастрофизация). Приоритетной задачей клинициста становится как можно более раннее купирование болевого синдрома. Например, при острой боли в спине, назначая НПВП, следует непрерывно наблюдать за динамикой боли и по мере ее купирования приступить к активизации пациента и постепенному увеличению его физической нагрузки.
Нередко врачи назначают НПВП при нейропатической боли. Однако их эффективность при этом типе боли является очень низкой, и их не включили в рекомендации по лечению нейропатической боли. НПВП эффективны при ноцицептивной боли, обусловленной процессами воспаления. При нейропатической боли главными в патогенезе являются периферическая, центральная сенситизация и дизингибиция, поэтому в ее лечении более эффективны препараты, направленные на эти патофизиологические механизмы (антиконвульсанты, антидепрессанты).
Разумеется, вопросы безопасности использования НПВП являются важными независимо от области применения. Несмотря на несомненную клиническую эффективность, назначение НПВП имеет свои ограничения.
Это связано с тем, что даже кратковременный прием этих препаратов в небольших дозах может приводить к развитию побочных эффектов, которые в целом встречаются примерно в 25% случаев, а у 5% больных могут представлять серьезную угрозу для жизни. Особенно высок риск побочных эффектов у людей пожилого и старческого возраста, которые составляют более 60% потребителей НПВП, поэтому в последние годы особое внимание привлечено к проблеме безопасного применения этих препаратов.
Механизм НПВП-индуцированных гастропатий складывается из локальных и системных эффектов ингибирования ЦОГ-1. Самыми частыми побочными эффектами НПВП являются диспептические явления: тошнота и рвота. НПВП-гастропатия определяется как патология верхних отделов ЖКТ, возникающая в связи с приемом НПВП и характеризующаяся повреждением слизистой оболочки (развитие эрозий, язв и их осложнений — желудочно-кишечное кровотечение, перфорация и нарушение проходимости ЖКТ). Увеличивают риск гастропатии возраст, наличие в анамнезе язвенной болезни, желудочно-кишечного кровотечения, прием стероидов. Это чрезвычайно опасный побочный эффект, который может привести к фатальным осложнениям (перфоративные язвы, желудочные кровотечения).
Среди врачей бытует мнение, что короткие курсы НПВП не вызывают гастропатий и что им всегда предшествуют диспептические жалобы. Коварство НПВП-гастропатий заключается в их «молчании». Показано, что нет прямой корреляции между язвообразованием и диспепсией. Примерно у 40% больных с эрозивным гастритом отсутствуют какие-либо симптомы диспепсии, а у 50% больных с диспепсией при эндоскопии не обнаруживается патологических изменений.
Особое внимание в настоящее время привлечено к потенциальному кардиоваскулярному риску, связанному с селективными по отношению к ЦОГ-2 препаратами. Большинство исследований свидетельствует, что кардиоваскулярный риск имеет значение только для страдающих кардиоваскулярными заболеваниями и по фатальным последствиям значительно ниже гастроинтестинального риска. В настоящее время получены убедительные клинические данные о том, что умеренное увеличение риска кардиоваскулярных осложнений является класс-специфическим эффектом НПВП и не зависит от их селективности по отношению к ЦОГ-2.
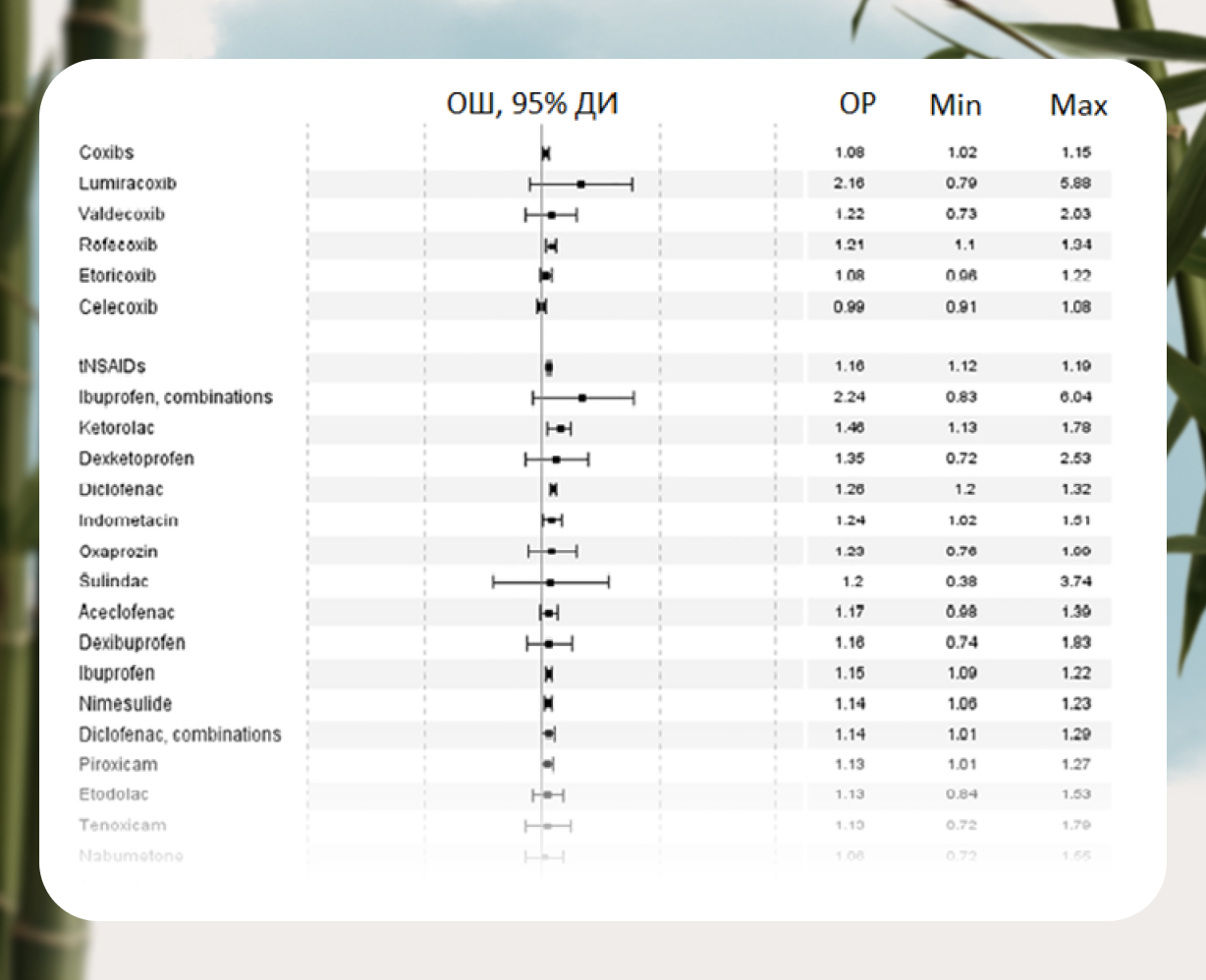
Сориентироваться в отношении потенциального риска развития побочных эффектов со стороны желудочно — кишечного тракта и сердечно-сосудистой системы у отдельных препаратов из группы НПВП могут помочь проведенные исследования. В одной из работ исследовалось влияние НПВП на состояние слизистой ЖКТ (A.Yanagawa и др.). Изучалась динамика эндоскопической картины у 30 здоровых добровольцев, в течение 2 недель получавших ацеклофенак, диклофенак или плацебо. Как оказалось, ацеклофенак, в отличие от диклофенака, практически не оказывал неблагоприятного действия: число лиц с эрозивными изменениями ЖКТ в группе ацеклофенака не отличалось от группы плацебо. В то же время через 2 недели приема диклофенака у многих участников исследования были выявлены эрозивные изменения, причем у 2 — множественные эрозии, а у 1 — язва желудка. Ацеклофенак демонстрирует наиболее низкий риск развития клинически выраженных язв и кровотечений и в реальной клинической практике, подтверждением чего стали результаты метанализа 28 эпидемиологических исследований (выполненных с января 1980 по май 2011 г.), в которых оценивался относительный риск (ОР) развития ЖКТ-осложнений при использовании различных НПВП. Ацеклофенак демонстрировал наименьший ОР 1,43 (0,65 — 3,15), такой же, как селективный ЦОГ-2 ингибитор целекоксиб — 1,45 (1,17 — 1,81). Опасность развития ЖКТ-осложнений была отчетливо выше при использовании ибупрофена — ОР 1,84 (1,54 — 2.20), диклофенака — 3,34 (2,79 — 3,99), мелоксикама — 3,47 (2,19 — 5,50), кетопрофена — 3,92 (2,70 — 5,69), напроксена — 4,1
Ацеклофенак оказался также среди препаратов обладающих наименьшим риском развития серьезных сердечно-сосудистых осложнений по результатам широкомасштабного исследования SOS в котором изучался относительный риск развития острого инфаркта миокарда и сердечной недостаточности связанных с текущим и недавним использованием отдельных НПВП.
Повышение печеночных ферментов является класс-зависимым побочным эффектом НПВП. Но в целом риск гепатопатий среди пациентов, принимающих НПВП, крайне мал. Подсчитано, что риск серьезных гастродуоденальных осложнений (кровотечение и перфорация) в 10 раз выше, чем гепатотоксичность.
В большинстве случаев повышение печеночных ферментов возникает у пожилых пациентов или больных, имеющих в анамнезе нарушения со стороны печени.
Непереносимость ацетилсалициловой кислоты (АСК) и других НПВП является значительной клинической проблемой. Наиболее известной гиперсенситивной реакцией является респираторный тип реакции (бронхоспазм или «аспириновая астма»). Гиперсенситивность к АСК встречается у
В отличие от многих генерических препаратов ибупрофена Нурофен® используется в различных энтеральных лекарственных формах, включая быстродействующие. К ним относят желатиновые капсулы, содержащие раствор ибупрофена в форме кислоты (Нурофен Экспресс), таблетки с быстрорастворимой натриевой солью ибупрофена (Нурофен 12+, Нурофен Экспресс Леди). В этих лекарственных формах препарат обладает наибольшей растворимостью в желудочно-кишечном тракте (ЖКТ), лучшей всасываемостью и биодоступностью. Эти лекарственные формы Нурофена назначают для купирования и лечения интенсивной острой боли. Они показаны к применению при головной боли разного генеза, в том числе при мигрени, зубной боли, боли после операции по удалению зубов, болезненных менструациях, невралгиях, болях в спине, мышечных и ревматических болях. Ибупрофен в дозе до 1200 мг/сут, особенно в лекарственных формах быстрого действия, является эффективным и безопасным препаратом данной группы, который может быть назначен врачом или применяться пациентами самостоятельно. Анальгетический эффект ибупрофена значительно возрастает при его сочетании с парацетамолом (Нурофен® Интенсив) по специальной технологии Synchro-Tech. Сочетанное применение этих анальгетиков обеспечивает высокий уровень обезболивания, существенно превышающий эффект от монотерапии данными препаратами. Терапевтический потенциал и благоприятный профиль безопасности ибупрофена и его сочетания с парацетамолом подтверждены большим числом хорошо организованных РКИ, выполненных с соблюдением всех принципов доказательной медицины.
В последнее время появились исследования указывающие на наличие у отдельных классов препаратов из группы НПВП иных механизмом действия, помимо ингибирования ЦОГ-1 и ЦОГ-2. Так, высокий противоболевой и противовоспалительный эффект препарата лорноксикам (относящегося к классу оксикамов) может объясняться его влиянием (помимо ингибирования ЦОГ-1 и ЦОГ-2 ) на центральные звенья патогенеза болевого синдрома. В недавних исследованиях было показано, что лорноксикам влияет на баланс цитокинов, а также стимулирует выработку эндогенного динорфина и эндорфина. Учитывая то, что лорноксикам сбалансированно ингибирует ЦОГ—1/ЦОГ—2, а также обладает более коротким периодом полувыведения чем другие оксикамы, применение этого препарата приводит к снижению риска возникновения нежелательных явлений, особенно со стороны желудочно-кишечного тракта.
Дополнительный механизм действия обнаружен также у НПВП из группы диацереинов. В нашей стране диацереин представлен препаратом диафлекс.
Диафлекс — относительно новый представитель медленных симптоммодифицирующих препаратов, рекомендованных для применения при суставной патологии.
Он ингибирует провоспалительный цитокин IL-1b и опосредованно снижает активность IL-6 и ФНО-a. При этом диафлекс не вызывает НПВП-гастропатий, так как не оказывает влияния на синтез простагландинов, на ССС, не вызывает гиперсенситивных реакций. Препарат обладает не только симптом-модифицирующим, но и доказанным в многочисленных исследованиях структурно-модифицирующим действием.
Назначать Диафлекс рекомендуют одновременно с НПВП, т.к. действие его развивается к концу второй недели от начала приема, применять его можно длительно — до
В клинической практике их используют в основном для лечения нейропатической боли. К болевым синдромам, которые реагируют на лечение антиконвульсантами, относятся — невралгия тройничного нерва, диабетическая невропатия, таламический синдром, посттерапевтическая невралгия. Кроме того, антиконвульсанты используют для превентивного лечения мигрени.
С
Антиконвульсанты обычно делят на два класса: препараты первого поколения и препараты второго поколения. Препараты первого поколения появились на рынке в начале ХХ века. Из-за лекарственных взаимодействий их применение может быть ограничено, особенно в высоких дозах. В табл. 1 перечислены классы антиконвульсантов первого поколения.
| Класс | Основные препараты |
| Гидантоины | фенитоин |
| Барбитураты | фенобарбитал примидон |
| Сукцинимиды | этозуксимид |
| Прочие | карбамазепин вальпроевая кислота |
| Бензодиазепины | диазепам лоразепам клоназепам |
Применение противосудорожных препаратов первого поколения, как правило, не рассматривается как терапия первой линии из-за связанных с их применением побочных эффектов. Мета-анализ данных клинических испытаний на пациентах с разными типами нейропатической боли, проведенный McQuay et al., показал, что противосудорожные препараты первого поколения не обеспечивают обезболивающего эффекта при нейропатической боли, но связаны со сходным риском побочных эффектов (табл. 2). Согласно аналогичному анализу, проведенному Wiffen et al., противосудорожные препараты первого поколения за исключением карбамазепина при невралгии тройничного нерва не следует применять, пока не испробованы другие способы лечения.
Таблица 2. Побочные эффекты, возникающие при применении антиконвульсантов первого поколения
Антиконвульсанты второго поколения начали появляться в начале
Таблица 3. Антиконвульсанты второго поколения
Антиконвульсанты имеют разные, иногда перекрывающиеся механизмы действия. Антиболевой эффект таких препаратов, как карбамазепин, фенитоин, окскарбазепин, ламотриджин, вальпроаты, топирамат, принято объяснять уменьшением высокочастотной по вторяющейся импульсации нейронов посредством блокирования по тенциалзависимых натриевых и кальциевых каналов в периферических нервах.
Кроме этого, ряд препаратов (например, фенобарбитал, тиагабин, топирамат, вигабатрин и вальпроаты) усиливают нервную передачу подавляющих импульсов либо непосредственно нарушают нервную передачу возбуждающих импульсов. Габапентин и прегабалин имеют принципиально новый механизм действия, что определило их лидирующие позиции на рынке препаратов для лечения нейропатической боли.
Это противосудорожный препарат первого поколения, который по химическому строению близок трициклическим антидепрессан там. Карбамазепин является препаратом первого ряда для лечения невралгии тройничного нерва. Данные по его эффективности при других типах нейропатической боли ограничены (малое количество проведенных испытаний и небольшое число участвовавших пациентов) . Карбамазепин обычно принимают в два или три приема. Препарат можно принимать во время или после еды либо между приемами пищи с небольшим количеством жидкости. Хотя у взрослых лечение можно начинать с дозы от 100 мг до 200 мг один или два раза в день, обычно ее увеличивают до
Он имеет структурное сходство с карбамазепином. Было проведено несколько клинических испытаний по лечению им тригеминальной невралгии с положительным эффектом. Окскарбазепин в дозе
Его период полувыведения составляет 10 часов, кратность приема — 2 раза в сутки. Для него характерны такие побочные эффекты, как седация, головокружение, снижение уровня натрия в сыворотке. Противопоказанием к назначению является АВ-блокада.
По этому препарату есть много убедительных рандомизированных, плацебоконтролируемых исследований, показавших его эффективность при нейропатической боли (в основном при постгерпетической невралгии и диабетической полиневропатии). Габапентин действует в пресинаптической части периферических сенсорных нейронов. Он связывается с добавочной субъединицей альфа-2-дельта (a2d) потенциалзависимых Са2+ каналов, которая расположена на внеклеточной стороне канала. При этом уменьшается приток кальция внутрь клетки, что тормозит высвобождение главных медиаторов боли — глутамата и субстанции Р. При снижении концентрации или отсутствии этих нейротрансмиттеров распространение болевого импульса на следующий нейрон блокируется (рис. 1).
Габапентин можно принимать независимо от приема пищи. Нет необходимости в измерении сывороточных концентраций для оптимизации лечения.
При нейропатической боли препарат следует титровать начиная с 300 мг/сут, увеличивая на 300 мг в день, до целевой суточной дозы, равной 1800 мг. При титровании дозы препарата не надо делить суточную дозу на равные части. При необходимости она может быть увеличена до 3600 мг. Время между приемами доз не должно превышать 12 часов. Пациентам преклонного возраста может потребоваться корректировка дозы, т.к. у них часто бывает нарушена функция почек. Наиболее частыми побочными эффектами (> 5%) являются головокружение (21,1%), сонливость (16,1%), реже наблюдаются понос (5,6%), головная боль (5,5%), тошнота (5,5%), периферические отеки (5,4%) и астения (5%).
Он близок по механизмам действия к препарату габапентин (рис. 1).
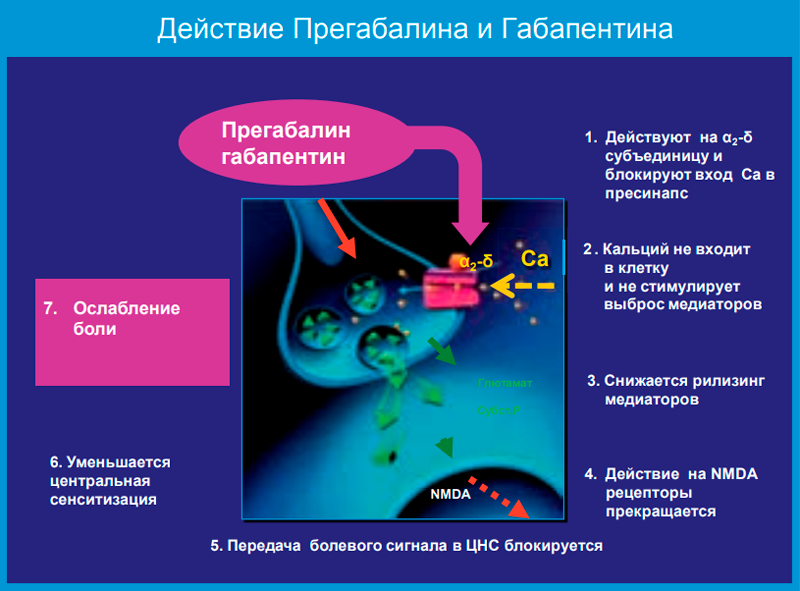
У прегабалина и габапентина похожий фармакологический профиль. Эти препараты относятся к одному классу средств, имеющих высокую аффинность к альфа-2-дельта протеину в центральной нервной системе (их иногда называют «габапентиноиды»). Исследования демонстрируют, что оба препарата уменьшают высвобождение глутамата и субстанцию в перевозбужденных нейронах. А поскольку выделение нейротрансмиттеров уменьшается, вероятность передачи нервного импульса на следующий нейрон становится ниже, что способствует редукции болевого синдрома. Важно отметить, что прегабалин оказывает эффект только в условиях перевозбуждения, что проявляется в модуляции, приводящей к переходу в нормальное состояние. Благодаря снижению высвобождения нейротрансмиттеров прегабалин селективно подавляет возбудимость сети нейронов, причем только при патологических состояниях.
Несмотря на наличие большого сходства между прегабалином и габапентином во многих отношениях фармакокинетический профиль имеет свои отличия. Линейность фармакокинетики прегабалина обеспечивает предсказуемость изменений концентрации данного препарата в плазме при увеличении или уменьшении вводимой дозы.
Это несвойственно габапентину, характеризующемуся нелинейностью фармакокинетики (при его введении в высоких дозах отмечается уменьшение всасывания препарата в кровь). В проведенных специальных исследованиях прегабалин показал эффективность, идентичную габапентину, но при существенно более низких дозировках. Вследствие этого вероятность побочных реакций у прегабалина значительно ниже, чем у габапентина. Одним из объяснений этого является тот факт, что прегабалин обладает более высокой биодоступностью (90% против
Большое количество исследований эффективности прегабалина было проведено на моделях постгерпетической невралгии и болевой диабетической невропатии. Дозировка прегабалина — от 300 до 600 мг/день показала себя наиболее эффективной по сравнению с плацебо, значительно уменьшая боль и нарушения сна. Диапазон суточных доз преагбалина
При лечении периферической нейропатической боли стартовая доза может составлять 150 мг/сут. В зависимости от эффекта и переносимости дозу можно увеличить до 300 мг/сут через
Для пациентов с болевой ДПН максимальная рекомендуемая доза прегабалина составляет 100 мг 3 раза в день (300 мг/день). У пациентов с клиренсом креатинина > 60 мл/мин введение препарата следует начинать с 50 мг 3 раза в день (150 мг/день), и в зависимости от эффективности и переносимости в течение первой недели лечения доза может быть увеличена до 300 мг/день.
Для пациентов с ПГН рекомендуемая доза прегабалина составляет от 75 до 150 мг 2 раза в день или от 50 до 100 мг 3 раза в день
Терапия с фибромиалгией проводится длительно — от 4 до 8 недель в суточной дозе от 300 до 600 мг.
Это антиконвульсант второго поколения с показанием к применению при эпилепсии. Он блокирует вольтаж — зависимые натриевые каналы. Проведено несколько исследований, в которых этот препарат оценивали при различных типах нейропатической боли. Эффективность доказана в нескольких исследованиях, включая лечение боли при ДПН, спинальной травме, тригеминальной невралгии, центральной постинсультной боли. В клинических испытаниях по нейропатической боли ламотриджин применяли в дозах от 200 до 400 мг/день. Обычно лечение начинали с 25 мг/день, далее титруя ее на повышение. Побочные реакции, о которых пациенты сообщали по ходу испытаний, включали кожную сыпь, головную боль, усталость, тошноту, головокружение и бессонницу.
Он имеет более сложную фармакодинамику — воздействует на ГАМК-рецепторы, блокирует каинат / АМПК-рецепторы, а также блокирует вольтажзависимые натриевые каналы. Таким образом, топирамат потенциально может снижать эктопическую активность (натриевые каналы), блокировать действие возбуждающих аминокислот при передаче импульса по синапсам в заднем роге (блокада каинат/АМПК-рецепторов) и увеличивать модуляцию болевых импульсов на сегментарном уровне в спинном мозге (ГАМК-эффект).
Сообщается об эффективности топирамата при различных болевых синдромах: мигрени, кластерной головной боли, SUNCT-синдроме, фантомной боли. Эффективность топирамата в профилактическом лечении мигрени подтверждена мультицентровыми рандомизированными, двойными слепыми, плацебоконтролируемыми исследованиями. В качестве монотерапии и в комбинированном лечении больных мигренью топирамат уменьшает частоту цефалгических атак и интенсивность боли, количество «болевых» дней и принимаемых для купирования приступа медикаментов, снижает количество приступов с тошнотой и рвотой, улучшает качество жизни пациентов. К числу несомненных достоинств препарата относится быстрое (в течение первого месяца лечения) наступление эффекта. Дозы топирамата, применяемые в терапии мигрени, значительно ниже противоэпилептических.
Сообщается об эффективности препарата в дозе
Роль антидепрессантов в лечении хронических болевых синдромов подтверждена документально. Не всегда ясно, приносят эти препараты облегчение хронической боли с помощью непосредственного антиноцицептивного действия или благодаря ослаблению такого вторичного симптома, как депрессия, которая часто наблюдается у этих пациентов. Однако в нескольких исследованиях зафиксированы прямые анальгетические свойства этих препаратов, не опосредованные антидепрессивным эффектом.
Трициклические антидепрессанты (ТЦА)
Они были среди первых препаратов, не относящихся к обезболивающим, которые последовательно демонстрировали свою эффективность при лечении пациентов с нейропатической болью. В табл. 1 перечислены имеющиеся на рынке трициклические препараты, большинство из которых применяется для лечения депрессивных расстройств.
| Группа | Название препарата |
| Третичные амины | кломипрамин имипрамин амитриптилин доксепин тримипрамин |
| Вторичные амины | дезипрамин нортриптилин протриптилин l |
Трициклические препараты блокируют обратный захват норадреналина и серотонина в пресинаптических нейронах. При этом в синапсе повышается уровень этих трансмиттеров. Обезболивающие эффекты ТЦА независимы от их антидепрессивных эффектов и обычно достигаются при использовании более низких доз. Хотя пока нет полной ясности в понимании механизма обезболивающего эффекта, считается, что торможение ими обратного захвата серотонина и норадреналина активизирует нисходящий путь торможения.
По всей видимости, в основе болеутоляющего действия ТЦА лежит торможение болевых сигналов. Показано также слабое влияние амитриптилина на блокирование натриевых каналов в периферических нервах.
ТЦА следует начинать с низкой дозы (например, 10 мг/день) и постепенно титровать ее на повышение. В клинических испытаниях по нейропатической боли ТЦА применяют в суточных дозах от 30 мг до 200 мг в день, хотя некоторым пациентам могут потребоваться более высокие дозы.
Помимо блокирования обратного захвата норадреналина и серотонина они в разной степени блокируют постсинаптические рецепторы некоторых нейротрансмиттеров, включая мускариновые холинергические, al-адренергические и гистаминовые рецепторы, что обусловливает целый ряд побочных эффектов (табл. 2).
| Тип блокируемого рецептора | Побочные эффекты |
| Мускариновые (антихолинергические эффекты) | нарушение зрения сухость во рту синусовая тахикардия запор задержка мочи спутанность сознания и/или нарушение памяти |
| Гистаминовые Н1 рецепторы | усиление эффектов препаратов подавляющих ЦНС седативный эффект сонливость увеличение веса |
| a1-адренергические рецепторы | ортостатическая гипотензия головокружение гипотензия рефлекторная тахикардия |
ТЦА следует применять с осторожностью у пациентов с сердечной патологией, глаукомой, задержкой мочи или вегетативными нарушениями. ТЦА могут вызывать нарушение равновесия и когнитивные расстройства у пациентов преклонного возраста, так что назначение им ТЦА может быть особенно проблематичным.
В Руководстве 2002 г. Американское общество геронтологов (АОГ) отмечает, что применение ТЦА связано со значительным риском возникновения побочных эффектов у пациентов преклонного возраста. Более того, АОГ не рекомендует назначать им амитриптилин. Надо регулярно снимать ЭКГ, особенно пациентам старше 40 лет. Поскольку ТЦА метаболизируются при участии ферментов системы цитохрома Р-450, они могут вступать во взаимодействие с другими препаратами, которые также метаболизируются этими ферментами.
Наиболее тяжелые побочные эффекты часто наблюдаются у пациентов старшей возрастной группы. Побочные эффекты можно ми¬нимизировать, начиная лечение с низкой дозы и постепенно титруя ее на повышение. Но т.к. для лечения нейропатической боли обычно используют более низкие дозы, чем при депрессивных расстройствах, для пациентов с нейропатической болью проблема побочных эффектов менее значима. Кроме того, они часто страдают расстройством сна, и седативный эффект, который вызывают многие ТЦА, может в ряде случаев расцениваться как дополнительная польза, а не как побочный эффект.
Многочисленные исследования показали, что антидепрессанты двойного действия СИОСН, используемые для лечения депрессии, также могут быть эффективны при лечении хронической боли. Оказалось, что двойное воздействие на серотонин и норадреналин обусловливает более выраженный эффект при лечении хронической боли, чем воздействие только не серотониновое звено. Антидепрессанты с двойным механизмом действия обладают более длительным обезболивающим эффектом, чем антидепрессанты, которые воздействуют только на одну из аминергических систем. Как серотонин, так и норадреналин вовлекаются в контроль боли через нисходящие пути болевой чувствительности. Предполагается, что анальгетический эффект этих антидепрессантов связан со способностью повышать активность норадреналина и серотонина в центральной нервной системе и он независим от антидепрессивного эффекта. Эти вещества уменьшают восприятие боли за счет активации нисходящей системы серотонинергической и норадренергической ингибиции.
Данных по применению венлафаксина при нейропатической боли мало. В одном рандомизированном перекрестном испытании венла факсина и имипрамина на пациентах с полинейропатией оба лекарства обеспечивали значительное уменьшение боли по сравнению с плацебо, при этом существенных различий между препаратами не было. При лечении депрессии быстродействующая форма препарата назначается 3 раза в день; форма XL вводится один раз в день. Не требуется корректировки дозы в зависимости от возраста, но дозы для пациентов с почечной или печеночной дисфункцией должны быть ниже. Наиболее частыми побочными эффектами являются тошнота (31% при применении препарата XL), бессонница, сухость во рту, сонливость, головокружение, запор, потливость, нервозность, астения и нарушение эякуляции/оргазма. Гипертензия является дозозависимым побочным эффектом, рекомендуется следить за артериальным давлением пациентов, принимающих венлафаксин.
Он показан для использования в качестве средства лечения НБ, связанных с диабетической полиневропатией (ДПН). Всасывание дулоксетина в кровь происходит относительно медленно; максимальная концентрация в плазме (СМАКС) достигается примерно через 6 часов после введения дозы препарата. При введении дулоксетина одновременно с приемом пищи его всасывание в кровь замедляется. При введении дулоксетина вечером его всасывание в кровь происходит медленнее, а клиренс примерно на 33% выше, чем при его введении утром. Дулоксетин активно связывается с белками (> 90%). После всасывания в кровь он быстро метаболизируется под действи ем цитохрома Р450 2D6 и 1А2. Было выдвинуто предположение, что метаболизация дулоксетина может приводить к образованию 25 метаболитов, большинство из которых образуют конъюгаты с глюкуроновой кислотой. Несколько первичных метаболитов дулоксетина оказывают воздействие на переносчиков
Одобрение применения дулоксетина в качестве средства лечения НБ, связанной с ДПН, основано на результатах нескольких крупных рандомизированных, двойных слепых, плацебоконтролируемых
Они включали в себя тошноту, запоры, уменьшение аппетита, сонливость, головную боль, головокружение, бессонницу, усталость и сухость во рту.
Дулоксетин утвержден FDA в качестве средства из группы СИОЗСН для лечения большого депрессивного расстройства, нейропатической боли при сахарном диабете и фибромиалгии. В исследованиях с использованием дулоксетина отмечалось более выраженное снижение общего балла по шкале тяжести фибромиалгии (FIQ) и 30%-ное уменьшение боли у 54% принимавших препарат по сравнению с 33% из группы плацебо.
Дулоксетин следует назначать раз в день в дозе 60 мг вне зависимости от приема пищи. Несмотря на продемонстрированную безопасность и эффективность дозы 120 мг/день, какие-либо свидетельства получения дополнительной значительной пользы при применении доз, превышающих 60 мг/день, отсутствуют. Кроме того, с повышением дозы препарата его переносимость явно ухудшается. При лечении пациентов с нарушением функции почек должен быть рассмотрен вопрос о более низкой стартовой дозе и постепенном титровании дозы.
Милнаципран, который широко используется в качестве антидепрессанта, утвержден FDA для лечения фибромиалгии. В ходе
Селективные ингибиторы обратного захвата серотонина (СИОЗС: флуоксетин, пароксетин, сертралин, циталопрам) имеют некоторые преимущества по сравнению с ТЦА при лечении депрессивных расстройств, в том числе благоприятный профиль переносимости, простота дозировки и ограниченность лекарственных взаимодействий.
Однако исследования, проводимые у пациентов с хронической болью, если и демонстрируют их эффективность, то лишь ограниченную. Это связано с механизмами действия. Эти вещества не влияют на нисходящую антиноцицептивную активность, не блокируют натриевые каналы и не обладают свойствами антагонистов NMDA-рецепторов.
Антидепрессанты показаны при нейропатической и дисфункциональной боли, а также у пациентов с длительным хроническим течением ноцицептивной боли при развитии центральной сенситизации и дизингибиции. Лечение следует начинать с малых доз, постепенно увеличивая до максимально переносимой. Важно ориентировать пациентов на длительный курс лечения, объясняя смысл назначения этих препаратов. Усиление нисходящей ингибиции за счет усиления норадренергических и серотонинергических модулирующих влияний считается основным механизмом анальгетического действия антидепрессантов. При необходимости антидепрессанты комбинируют с антиконвульсантами. Отмена проводится постепенно в течение
Активатор калиевых каналов — флупиртин (катадолон) синтезирован в
Флупиртин является прототипом нового класса веществ — селективных активаторов нейрональных калиевых каналов. Относится к неопиоидным анальгетикам центрального действия, не вызывающим зависимости и привыкания. Флупиртин обладает анальгезирующим, миорелаксирующим, нейропротективным действием и способствует предотвращению хронизации боли.
Это свойство флупиртина обусловлено преимущественно его непрямым антагонизмом с NMDA-рецепторами. В терапевтических дозах препарат способствует открытию потенциалнезависимых калиевых каналов, что приводит к стабилизации мембранного потенциала нервной клетки (рис. 1).
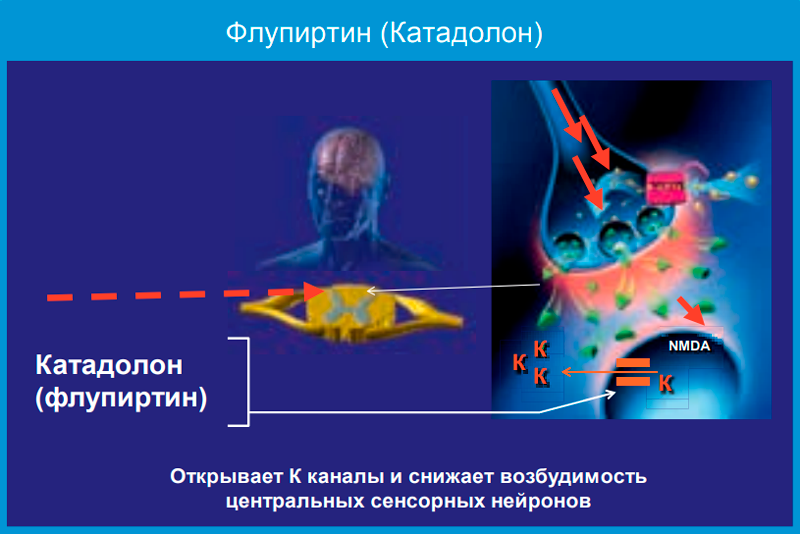
Установлено, что влияние на ток ионов калия опосредовано воздействием этого лекарства на систему регуляторного G-белка, что вызывает угнетение активности NMDA-рецепторов и как следствие — блокаду нейрональных ионных каналов кальция, снижение внутриклеточного тока ионов кальция, угнетение возбуждения нейрона в ответ на ноцицептивные стимулы. В результате нарушается формирование ноцицептивной сенситизации (болевой чувствительности) и феномена «wind up» — увеличения нейронального ответа на повторные болевые стимулы. Это в свою очередь предотвращает усиление боли и переход ее в хроническую форму, а при уже имеющемся хроническом болевом синдроме способствует его уменьшению. Установлено также модулирующее влияние катадолона (флупиртина) на перцепцию боли через нисходящую норадренергическую систему.
Оно обусловлено воздействием на поперечно полосатую мускулатуру. Этот эффект реализуется благодаря блокированию передачи возбуждения на мотонейроны и промежуточные нейроны спинного мозга. В значительной степени этот эффект может быть опосредован стимуляцией ГАМК-рецепторов. Флупиртин снимает региональный мышечный спазм, связанный с болью, при этом не влияя на общий мышечный тонус, который нормализуется без влияния на общую мышечную силу. Миорелаксирующий эффект флупиртина является ценным дополнением к анальгезирующему действию препарата, т.к. большинство болевых синдромов сопровождается мышечным спазмом.
Большой интерес представляют нейропротективные свойства флупиртина, обусловленные существованием антагонизма по отношению к NMDA-рецепторам и блокированием «глутамат-кальциевого каскада», ингибированием процессов апоптоза, что было убедительно продемонстрировано в эксперименте на культуре нервной ткани. Имеются данные об использовании нейропротективного эффекта катадолона в условиях ишемии головного мозга, его токсического поражения. Считается также, что флупиртин обладает и антиоксидантным действием.
Особенностью многих болевых синдромов является их сочетание с изменениями в эмоциональной сфере, способствующими хронизации состояния.
Анальгетическое действие флупиртина основано на активации потенциалнезависимых калиевых каналов, что приводит к стабилизации мембранного потенциала нервной клетки и торможению возбуждения нейрона в ответ на ноцицептивные стимулы. Сдерживание формирования центральной сентизации и феномена «wind up» предотвращает усиление боли, переход ее в хроническую форму, а при уже имеющемся хроническом болевом синдроме ведет к снижению его интенсивности.
Учитывая центральный — спинальный и супраспинальный уровни воздействия препарата, важным достоинством флупиртина является отсутствие развития привыкания или зависимости. В ходе опытов на животных (с использованием различных методов исследования) не было получено доказательств развития привыкания или зависимости даже при длительном применении препарата.
Об отсутствии развития зависимости от лекарственного препарата свидетельствуют следующие данные: за период
Результаты, полученные при использовании катадолона в лечении хронической ГБН, показали высокую эффективность. После проведения курса лечения по 300 мг в день в течение 8 недель статистически значимо снижалось количество приступов головной боли, сокращались ее продолжительность и интенсивность. В результате лечения катадолоном был продемонстрирован миорелаксирующий эффект препарата — достоверно снизилось напряжение перикраниальных и шейных мышц, что, по-видимому, способствовало уменьшению сенситизации периферических ноцицепторов у больных с ГБН после лечения. Повышение порогов болевой чувствительности после лечения свидетельствовало об уменьшении центральной сенситизации ноцицептивных нейронов, стабилизации мембраны афферентных ноцицептивных нейронов и уменьшении передачи ноцицептивных стимулов, играющих ведущую роль в патогенезе ГБН.
Эффективность и безопасность катадолона изучена в многочисленных открытых сравнительных и несравнительных исследованиях, нескольких плацебоконтролируемых исследованиях. Наибольший интерес с точки зрения доказательной медицины представляют результаты мультицентрового рандомизированного двойного слепого исследования, выполненного в Германии, посвященного изучению флупиртина (катадолона) в сравнении с миорелаксантом хлормезаноном и плацебо для лечения хронической миофасциальной боли в нижней части спины (Worz, 1996). Результаты исследования показали, что позитивно отреагировали на терапию флупиртином 60,9% испытуемых, хлормезаноном — 47,8%, а плацебо-эффект был получен у 43,8%. Эффективность флупиртина была достоверно выше, чем у плацебо (р = 0,007). Анализ безопасности лекарственных препаратов в сравниваемых группах выявил наличие нежелательных реакций у 14,8% принимавших флупиртин, у 19,3% — при приеме хлормезанона, в группе плацебо «побочные» эффекты отметили 7,3%. Исследовате ли констатировали, что флупиртин обладает адекватным профилем эффективности и безопасности у больных, страдающих хронической болью в нижней части спины.
Оценка переносимости флупиртина в рамках открытого мультицентрового одногодичного исследования проведена W. Неггтап и соавт. в 1993 году. В открытое проспективное исследование были включены пациенты (191 человек) с хронической болью при дегенеративных и/или воспалительных заболеваниях опорно-двигательного аппарата (артрозы, дегенеративные изменения позвоночника), болью, связанной с ревматическими расстройствами (хронический полиартрит, болезнь Бехтерева, внесуставной ревматизм), другой хронической болью (головная боль и др.). Длительность терапии составила 52 недели при схеме приема 100 мг флупиртина в капсулах 3 раза в сутки. Оценивались переносимость флупиртина, длительность обезболивающего эффекта, возможный синдром отмены или указание на возникновение зависимости.
На основании отзывов пациентов и выводов исследователей с учетом данных лабораторной диагностики и физикального обследования больных выявлено, что препарат обладает хорошим профилем безопасности, подтвержденным на фоне применения в течение 52 недель, с наличием дозозависимого эффекта, при этом спектр побочных явлений представлен меньше по сравнению с больными, принимавшими опиоиды или НПВП. Авторы рекомендуют флупиртин в качестве моно- и комбинированной терапии в сочетании с НПВП, опиоидами и антидепрессантами.
До последнего времени на российском фармацевтическом рынке была представлена единая форма катадолона — капсулы по 100 мг. В настоящее время появилась новая пролонгированная форма препарата — катадолон форте: таблетки по 400 мг обладают следующими преимуществами:
Наиболее очевидны преимущества пролонгированной формы флупиртина (катадолон форте) в случаях проведения длительных курсов лечения и использования высоких дозлекарства. В настоящее время опубликованы последние данные завершающегося в Германии исследования по оценке эффективности и безопасности пролонгированной формы флупиртина (катадолон форте) (Oderail М.А., 2012). В проспективном рандомизированном двойном слепом плацебо и активноконтролируемом мультицентровом исследовании приняли участие 363 пациента с умеренной и выраженной хронической болью в спине. Они были рандомизированы 1:1:1 получать либо 400 мг флупиртина модифицированного высвобождения (MR), либо 200 мг трамадола замедленного высвобождения (ER), либо плацебо. Препараты принимали один раз в сутки в течение 4 недель. Результаты этого исследования продемонстрировали, что анальгетичесикй эффект 400 мг флупиртина MR был сравним с 200 мг трамадола ER. Основные преимущества флупиртина MR перед трамадолом ER состоят в лучшей переносимости и меньшем количестве побочных эффектов, особенно со стороны ЖКТ и ЦНС (р 0,039). Кроме того, процент больных, прекративших лечение по причине побочных явлений, был достоверно ниже у флупиртина MR по сравнению с трамадолом ER (р = 0,017). При лечении флупиртином MR отмечалось достоверное уменьшение интенсивности боли в отличие от группы с плацебо (р = 0,003). Напротив, группа, получавшая трамадол ER, не смогла достичь лучшего эффекта обезболивания, чем у принимавших плацебо.
Такие результаты могут быть обусловлены тем, что многие пациенты из группы трамадола прекращали лечение из-за побочных эффетков. Исследование показало, что улучшенный профиль переносимости флупиртина модифицированного высвобождения и анальгетический эффект, сопоставимый с трамадолом замедленного высвобождения, позволяют рекомендовать это соединение для ежедневного приема в терапии хронической боли.
Таким образом, фармакодинамические эффекты флупиртина, реализующие свое анальгетическое действие на уровне как ноцицептивной, так и антиноцицептивной системы, позволяют использовать препарат в лечении болевых синдромов с разными патофизиологическими механизмами. Важным свойством флупиртина является способность подавлять процессы центральной сенситизации и, следовательно, предотвращать хронизацию болевого синдрома. Относясь к непрямым блокаторам NMDA-рецепторов и обладая нисходящей норадренергической активностью, флупиртин можно использовать в лечении нейропатической боли в составе комбинированной терапии. В большей степени его применение обосновано при смешанных болевых синдромах, где он одновременно воздействует на ноцицептивный и нейропатический компоненты боли.
Кремы, пластыри и гели с 5%-ным содержанием лидокаина (или в комбинации с прокаином) относятся к анестетикам местного действия. Пластырь с лидокаином (версатис) выпускается в виде трансдермальной терапевтической системы и зарегистрирован для лечения нейропатической боли при постгерпетической невралгии. Лидокаин проникает через кожу и, блокируя натриевые каналы в нервных окончаниях, препятствует передаче болевых сигналов. Как следствие предотвращается развитие аллодинии (возникновение ощущения боли в ответ на неболевое раздражение) и центральной сенситизации, с которой связана хронизация боли.
Единственное официально зарегистрированное показание к применению версатиса — боль при постгерпетической невралгии. Тем не менее в США, Европе и в России лидокаиновый пластырь успешно применяется при широком спектре болевых синдромов, таких, как периферические полинейропатии, в том числе диабетическая, компрессионно-ишемическая нейропатия (туннельный синдром), послеоперационная или посттравматическая боль в области кожных рубцов, боль в спине и др. Имеется опыт успешного применения версатиса и при заболевании суставов и позвоночника как воспалительного, так и дегенеративного характера, сопровождавшихся болевым синдромом (дорсопатия, остеохондроз, остеоартроз, ревматоидный артрит, анкилозирующий спондилоартрит, плече лопаточный периартрит). В ряде клинических исследований показана также эффективность местного применения лидокаина при диабетической полиневропатии и КРБС, однако рекомендовать препарат при этой патологии в силу отсутствия доказательных данных пока рано.
Поскольку системная абсорбция лидокаина отсутствует, версатис отличает высокая безопасность. Возможно его использование у больных с сопутствующими заболеваниями, а также в комбинации с другими препаратами.
За время существования версатисана фармацевтическом рынке многие врачи успели приобрести опыт его применения, правда наряду с успехами есть и неудачи. Настало время провести «работу над ошибками». Часть неудач объясняются тем, что для достижения эффекта недостаточно просто назначить препарат — важно правильно определить показания к его применению, объяснить пациенту особенности его использования и учесть психологические факторы. Как и другие средства для лечения боли, версатис сам по себе не является ни эффективным, ни бесполезным. Он действует, когда используется правильно и по показаниям и когда врач не просто выписывает рецепт, а помогает пациенту обрести контроль над болью.
Во всех остальных случаях он бесполезен. Для определения показаний к применению лидокаинового пластыря недостаточно установления нозологической пренадлежности, следует ориентироваться в первую очередь на характеристики и механизмы боли. Препарат эффективен при поверхностной локали зованной боли, что объясняется небольшой глубиной диффузии лидокаина. Версатис особенно показан при наличии аллодинии — мучительного состояния, проявляющегося в ощущении боли в ответ даже на неболевое раздражение — например, при прикосновении одежды. Блокируя эктопическое распространение болевых сигналов, лидокаин устраняет феномен аллодинии эффективнее, чем препараты системного действия.
Начинать лечение всегда лучше с назначения какого-либо одного препарата, т.е. монотерапии. Однако в случае, когда этим не удается добиться клинического эффекта правильной тактикой будет комбинированное применение версатиса с другими средствами лечения нейропатической боли. В исследовании эффективности версатиса и прегабалина для лечения постгерпетической невралгии было показано, что пациенты, которые плохо отвечали на монотерапию версатисом или прегабалином, почувствовали клинически значимое улучшение при приеме двух препаратов. Повышения эффективности терапии можно также достичь при комбинировании версатиса с антидепрессантами (дулоксетин, венлафаксин). Следующей ступенью при недостаточной эффективности двух препаратов (версатис + антидепрессант или версатис + антиконвульсант) является одновременное применение трех препаратов для лечения нейропатической боли: версатис + антидепрессант4- антиконвульсант. Поскольку лекарственные средства разных групп обладают различными механизмами действия, их сочетанное использование повышает суммарную эффективность терапии.
В целом лидокаиновые пластыри безопасны и просты в применении. Однако есть несколько особенностей, которые должен знать врач и о которых необходимо рассказать пациенту (рис. 1).

К группе препаратов, способных уменьшить напряжение мышц, следует отнести традиционные миорелаксанты (баклофен, тизанидин, толперизон), а также флупиртин (катадолон), диазепам и ботулотоксин. Термин «миорелаксанты» не очень удачный, поскольку эти препараты не оказывают периферического действия на «напряженные мышцы» — они скорее действуют в ЦНС на разные мишени (рис. 1).
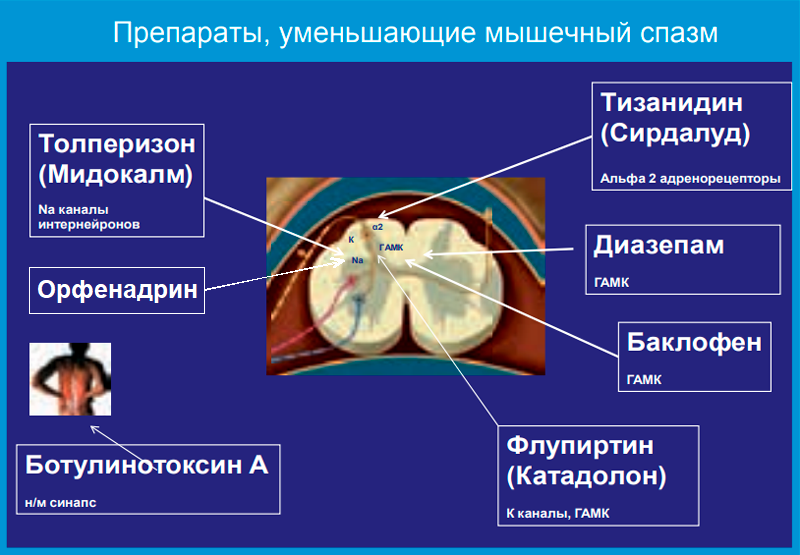
Применение миорелаксантов обосновано признанием важной роли мышечного спазма в патогенезе боли в нижней части спины. Боль различного генеза (вследствие поражения межпозвонковых дисков, фасеточных суставов позвоночника, самих мышц и других причин) повышает активность двигательных нейронов спинного мозга, что приводит к мышечному спазму, который в свою очередь играет значительную роль в поддержании самой боли. Патологически повышенный мышечный тонус имеет различные механизмы усиления боли: непосредственное раздражение болевых рецепторов мышц, ухудшение их кровоснабжения, что приводит к образованию порочного круга, ведущего к усилению мышечного спазма и сопровождающей его боли.
Миорелаксанты разрывают порочный круг «боль — мышечный спазм — боль» и вследствие этого способны ускорять период выздоровления.
Он эффективен для лечения мышечного спазма в основном за счет облегчения трансмиссии с помощью гамма-аминомасляной кислоты (ГАМК) в ЦНС. Баклофен назначают в низких дозах с по следующим постепенным повышением до
Тизанидин относится к миорелаксантам центрального действия (альфа-2-адренергическим агонистам) и реализует свой эффект на спинальном и супраспинальном уровне. Стимулируя пресинаптические альфа-2-рецепторы, он подавляет высвобождение возбуждающих аминокислот, которые стимулируют NMDA-рецепторы. Это приводит к подавлению передачи возбуждения через полисинаптические рефлексы спинного мозга. Препарат преимущественно угнетает поли синаптические рефлексы спинного мозга, ответственные за гипертонус мышц, что вызывает снижение повышенного тонуса сгибательной и разгибательной мускулатуры и уменьшение болезненных мышечных спазмов.
В дополнение к миорелаксирующим свойствам тизанидин оказывает также центральный умеренно выраженный анальгезирующий эффект (за счет снижения высвобождения возбуждающих нейромедиаторов в головном мозге на уровне locus ceruleus). Тизанидин выпускается в виде таблеток 2 мг и 4 мг для приема внутрь, а также капсул 6 мг с модифицированным высвобождением препарата (сирдалуд МР).
При легких болевых синдромах назначение тизанидина можно ограничить приемом препарата
При этом пациент «переспит» побочные эффекты. Затем постепенно повысить до
В тяжелых случаях можно добавить еще
Орфенадрин — препарат с разнообразными фармакологическими свойствами, которые позволяют классифицировать его как миорелаксант центрального действия, анальгетик центрального действия, а также как антихолнергическое средство для лечения паркинсонизма. В США он является одним из самых широко применяемых миорелаксантов, который только для лечения острой боли в спине ежегодно получают более 250 000 пациентов отделений неотложной помощи [1].
По химической структуре орфенадрин близок антигистаминному препарату дифенгидрамину [2], ненаркотическому анальгетику нефопаму [3] и блокаторам натриевых каналов — местному анестетику лидокаину, антиаритмику мексилетину и антиконвульсанту фенитоину [4] и обладает сходными с ними механизмами действия.
Он блокирует рецепторы N-метил-D-аспартата (NMDA) [5], H1-гистаминовые рецепторы, мускариновые рецепторы и взаимодействует с системой обратного захвата норадреналина [6]. Кроме того, подобно местным анестетикам, орфенадрин ингибирует натриевые каналы, нарушая проведение нервных импульсов [7]. Блокада специфических натриевых каналов приводит к облечению острых нейропатических и воспалительных болей, что было показано в исследованиях на животных и подтверждается результатами генетических исследований у людей и трансгенных мышей [80,81]. При интратекальном введении в эксперименте орфенадрин превосходил по мощности и длительности местноанестезирующего действия лидокаин [6].
Орфенадрин также обладает слабым седативным эффектом и снижает патологически повышенный тонус скелетной мускулатуры, не оказывая влияния на нормальный тонус и произвольные движения [8]. При этом анальгезирующий и миорелаксирующий эффекты препарата не зависимы друг от друга [9].
Сочетание фармакодинамических свойств орфенадрина с хорошим проникновением через гематоэнцефалический барьер обусловливает его терапевтический эффект при воспалительных и нейропатических болях, включая послеоперационную боль, боль в плече, шее, нижней части спины, радикулопатии, другие острые и хронические скелетномышечные заболевания, а также при головных болях напряжения [9, 7]. Эффетивность орфенадина при этих состояниях была продемонстрирована в клинических исследованиях как при применении в виде монотерапии, так и в комбинации с парацетамолом или диклофенаком [9,
При совместно применении орфенадрина с диклофенаком наблюдается аддитивный анальгезирующий эффект, обусловленный различными механизмами действия препаратов, что подтверждается результатами целенаправленного сравнительного исследования фиксированной комбинации орфенадрина с диклофенаком с монотерапией ее ингредиентами [12]. Высокая эффективность инфузий комбинации диклофенака и орфенадина была продемонстрирована при болевых спинальных синдромах, остеоартрите, внесуставном ревматизме, болях при остеопорозе и в послеоперационном периоде [14].
Его миорелаксирующий эффект обусловлен в первую очередь мембраностабилизирующим действием на периферические нейроны, спинальные интернейроны и мотонейроны, что приводит к блокированию моно- и полисинаптических спинно-мозговых рефлексов.
Вторично вследствие торможения поступления Са2+ в пресинаптические окончания тормозит выделение медиаторов в синапсах, а также способствует торможению проведения возбуждения по ретикулоспинальному пути, избирательно снижает активность каудальной части ретикулярной формации головного мозга, уменьшая мышечный тонус.
Обладает слабым спазмолитическим и адреноблокирующим эффектом, усиливает периферический кровоток независимо от влияния ЦНС. Хорошо переносится пожилыми пациентами, не обладает кардиотоксическим действием, лишен седативного эффекта и не ухудшает когнитивные функции больных. Также безопасен в отношении уровня артериального давления, что особенно важно для пациентов с болевым синдромом и сопутствующими сердечно-сосудистыми заболеваниями.
В ходе исследовательских работ последних лет Мидокалм доказал отсутствие необходимости титрации на этапе старта терапии, назначаясь сразу в эффективной схеме 450мг/сут (150мг 3 раза в день). Единственный миорелаксант, выпускающийся в инъекционной форме. На данный момент существует ряд клинических работ, в которых показана эффективность Мидокалма раствора в купировании триггеров при миофасциальном болевом синдроме. Мидокалм раствор может применяться как самостоятельно с целью купирования триггера, так и с разведением небольшим количеством местного анестетика в триггер.
После короткого курса раствором внутримышечно рекомендуется перевод на таблетки Мидокалма 450мг/сут для формирования устойчивого результата терапии. Рекомендуемый курс назначения Мидокалма составляет не менее 15 дней длительностью по показаниям.
При купировании острой боли очень важно как можно быстрее включать в терапию физические упражнения, лечебную физкультуру и активизировать больного.
Интерес к широкому применению комбинации витаминов группы В при боли пришел из практики. С 1950 года во многих странах мира их стали рассматривать как анальгетики. Хорошо известно, что витамины группы В являются нейротропными и существенным образом влияют на процессы в нервной системе. У нас в стране их применяют очень широко. Особенно популярны инъекции как отдельных витаминов (B1, Вб, В12), так и их комбинаций. Клинический опыт показывает, что парентеральное использование тиамина (Bi), пиридоксина (Вб) и цианокобаламина (В12) хорошо купирует боль, нормализует рефлекторные реакции, устраняет нарушения чувствительности. При болевых синдромах врачи нередко прибегают к использованию витаминов этой группы в комбинации с другими препаратами.
Популярность витаминов группы В связана и с другими аспектами. В работе с пациентами, страдающими различной болью, нередко приходится сталкиваться с определенными трудностями. Во-первых, это всевозможные осложнения фармакотерапии. Применение НПВП нередко отвергается самими больными из-за побочных эффектов, главным образом со стороны ЖКТ. Во-вторых, при неэффективности какого-либо лекарства приходится назначать одновременно препараты нескольких групп, что увеличивает риск побочных эффектов, а также, как правило, повышает стоимость лечения. В-третьих, у многих пациентов существуют противопоказания к проведению различных обезболивающих физиотерапевтических процедур (электро- и магнитотерапия, тепловые процедуры и т.д.). Часто больные из-за боли не могут выйти из дома, и соответственно проведение каких-либо процедур вне дома исключается. Кроме того, не всегда удается сделать необходимые мышечные или эпидуральные блокады из-за отсутствия соответствующих условий или специалистов.
В настоящее время опубликовано более 100 исследований, показавших клиническое улучшение при применении витаминов группы В у пациентов с болевыми синдромами. При этом не до конца изучен ряд вопросов. Обладают витамины группы В анальгетическими свойствами? Каков механизм действия? Насколько безопасна комбинация этих витаминов? Можно ли их сочетать с НПВП при боли? Является ли такое комбинированное лечение более эффективным, чем монотерапия? Насколько витамины группы В эффективны в лечении боли в спине? Пока убедительных научных данных, доказывающих, что уменьшение боли связано с конкретными анальгетическими свойствами именно витаминных препаратов, немного. Однако уже проведено несколько специальных клинических и экспериментальных исследований по изучению витаминов группы В как потенциальных анальгетиков при различных болевых синдромах.
С 1950 года витамин В12 стал рассматриваться во многих странах как анальгетик. Из 94 исследований его применения при боли только в одном случае не было показано положительного результата. Но все эти работы не соответствовали современным требованиям проведения исследований. В 2000 году было проведено первое рандомизированное контрольное исследование внутримышечных инъекций витамина В12 при хронической боли в спине. На материале 60 больных от 18 до 65 лет показаны достоверное уменьшение боли и улучшение двигательных функций. В другом исследовании проводилось сравнение эффективности витамина В12 с антидепрессантом — нортриптилином в лечении нейропатической боли у 100 пациентов с диабетической полиневропатией. Было отмечено достоверное снижение боли по ВАШ на 3.66 балла в группе, получавшей инъекции витамина В12, по сравнению с группой, получавшей нортриптилин (уменьшение боли на 0.84 балла по ВАШ). Достоверно отмечалось уменьшение парестезий, ощущения жжения и зябкости.
По данным большого мета-анализа 13 рандомизированных исследований тиамина при диабетической и/или алкогольной полиневропатии (741 пациент), проведенных за
Витамин В6 наиболее часто используется в лечении боли при туннельных синдромах. Из 14 исследований пиридоксина при синдроме запястного канала в 8 из них получен положительный результат, в других — либо отсутствие эффекта, либо недоказуемый эффект.
Однако следует заметить, что пиридоксин в больших дозах может вызывать токсический эффект. В настоящее время для лечения синдрома запястного канала безопасной считается доза 200 мг/сут. При более высокой суточной дозе рекомендуется проводить контроль концентрации пиридоксина в крови. Риск токсических эффектов (сенсорная невропатия) возникает при суточной дозе выше 500 мт. В лечении синдрома запястного канала рекомендуют сочетать витамин В6 с НПВП в течение 3 месяцев.
Во многих работах подчеркивается, что лечение боли комбинациями витаминов В1, В6 и В12 более эффективна, чем монотерапия каким-либо одним из этих витаминов.
Было показано, что рекомендуемый диапазон доз витаминов В1 В6 и В12 либо не приводит к развитию нежелательных явлений, либо их выраженность незначительна. Авторы делают вывод о том, что в острых случаях внутримышечные инъекции в ампулах следует делать один раз в день, при менее тяжелых состояниях или во время периода реабилитации рекомендуется только одна инъекция два или три раза в неделю. Не вызывает сомнений, что регулярные инъекции препарата способствуют положительному настрою пациента на терапию, что позволяет осуществлять полноценный лечебный процесс. Этот момент имеет значение с точки зрения лучшего понимания врачом особенностей течения болезни при проведении такого лечения. В работе подчеркивается, что, несмотря на существование различных точек зрения, в настоящее время использование витаминов группы В можно считать успешным методом лечения целого ряда нейропатий и различных видов боли в спине.
Таблетированный комплекс витаминов группы В, содержащий витамин В1 (бенфотиамин) 100 мг в сочетании с витамином В6 (100 мг) и В12 (2 мкг) представлен в лекарственном препарате Комбилипен® табс. Инъекционный комплекс витаминов группы В (Комбилипен®) содержит в себе витамин В1 (100 мг), витамин В6 (100 мг), витамин В12 (1 мг) и 20 мг лидокаина. Наличие анестетика позволяет сделать инъекции практически безболезненными, что повышает приверженность пациентов терапии. Курс лечения составляет до
По данным ряда клинических исследований длительность терапии болевых вертебральных синдромов может быть уменьшена за счет применения комбинации витаминов В1, В6, В12 и диклофенака вместо проведения монотерапии диклофенаком.
Кроме того, при проведении указанной комбинированной терапии может быть достигнут более выраженный анальгезирующий эффект. Для проверкиэтой гипотезы в 1990 году было проведено сравнение клинической эффективности диклофенака (25 мг) и комбинированного препарата, в состав которого были включены диклофенак (25 мг), витамины B1 (50 мг), В6 (50 мг) и В12 (0,25 мг), в многоцентровом рандомизированном двойном слепом исследовании с участием 418 пациентов. Все больныеполучали по 2 капсулы 3 раза в сутки не более
53 из 184 больных, получавших комбинированную терапию, и 48 из 192 больных, получавших только диклофенак, могли прекратить прием препарата в связи с существенным уменьшением боли после недели лечения. Различия, полученные в пользу комбинации диклофенака и витаминов группы В, были статистически значимыми у пациентов, которые на момент начала лечения страдали тяжелой болью. Различия по нежелательным явлениям в сравниваемых терапевтических группах были недостоверными. В результате проведенного клинического исследования получены доказательства большей эффективности комбинированной терапии диклофенаком и витаминами группы В, чем при использовании одного диклофенака для лечения болевого вертебрального синдрома. Идентичные результаты были получены еще в нескольких клинических исследованиях у пациентов с дегенеративными заболеваниями на уровне поясничного отдела позвоночника. При этом любопытно отметить, что в исследовании витаминов группы В и диклофенака при экспериментальной боли у здоровых лиц был отмечен анальгезирующий эффект, но он не зависел от витаминов. В результате многочисленных дискуссий с привлечением специалистов различных направлений было принято решение о необходимости создания доказательной базы в виде проведения обширных двойных слепых исследований по изучению эффективности комбинаций витаминов группы В. В 38 частных медицинских центрах Западной Германии было предпринято многоцентровое двойное слепое исследование эффективности диклофенака по сравнению с его комбинацией с витаминами группы В. Согласно результатам этого крупного многоцентрового исследования, объединившего 400 больных, комбинация витаминов группы В + диклофенак характеризовалась тенденцией к большей эффективности.
Терапевтический эффект наблюдался в более короткие сроки при использовании комбинации препаратов, чем при лечении одним диклофенаком, при этом результаты комбинированной терапии были лучше. Проведенное исследование также позволяет сделать вывод, что различия могут быть более отчетливыми при лечении только пациентов с выраженным или чрезвычайно выраженным болевым синдромом, а также при терапии меньшими ежедневными дозами диклофенака. В нашей работе указывается о проведении сравнительного исследования эффективности комбинированного витаминного препарата Мильгамма (Верваг Фарма, Германия), диклофенака (75 мг/сут внутримышечно) и их комбинации в лечении острой боли в нижней части спины у 90 больных (3 группы по 30 пациентов). Одна ампула препарата содержит витамин B1 (100 мг), витамин В6 (100 мг), витамин В12 (1000 мкг) и 20 мг лидокаина. Присутствие анестетика в «Мильгамме» позволяет сделать инъекции практически безболезненными и повышает приверженность пациента терапии. Курс лечения составлял до 14 дней. Эффект нейротропного комплекса Мильгамма был сопоставим с эффектом диклофенака, однако побочные явления были более выражены при монотерапии последним. Комбинация диклофенака с Мильгаммой достоверно более эффективна, чем монотерапия диклофенаком или комплексом витаминов. Показано более быстрое и выраженное снижение боли уже на второй день терапии, что очень важно особенно при интенсивной боли. Вполне вероятно, что комбинированная терапия может сократить сроки лечения, кроме того, она позволяет обсуждать применение более низких доз НПВП при их сочетании с витаминным комплексом. Эффект препарата Мильгаммы, не относящегося к обезболивающим средствам, оказался сопоставимым с диклофенаком — классическим обезболивающим средством. Это может свидетельствовать о том, что Мильгамма обладает четким анальгетическим механизмом действия и не является результатом обычного традиционного физиологического воздействия этих витаминов.
Обобщая данные по применению комплекса витаминов группы В с НПВП при боли в спине, можно сделать несколько выводов. Витамины группы В усиливают анальгезию при одновременном их применении с диклофенаком (НПВП). При комбинированной терапии с нейротропным комплексом острота боли по субъективному отчету больных достоверно уменьшается раньше, чем при монотерапии НПВП. При комбинации НПВП с витаминами группы В можно снизить дозу НПВП.
В нескольких работах подчеркивается, что как комбинация, так и раздельное применение витаминов В1 В6 и В12 обладает анальгезирующим эффектом (рис. 1).
В экспериментальной работе по изучению эффектов комбинации витаминов В1 В6 и В12 при боли показано ингибирование ноцицептивных ответов, вызванных формальдегидом, не меняющееся после введения налоксона. Выдвинуто предположение, что антиноцицептивный эффект комбинированного витаминного комплекса может быть обусловлен ингибированием синтеза и/или блокированием действия воспалительных медиаторов. В другой работе показано, что комплекс витаминов группы В усиливает действие норадреналина и серотонина — главных «антиноцицептивных» нейромедиаторов. Кроме того, в эксперименте обнаружено подавление ноцицептивных ответов не только в заднем роге, но и в зрительном бугре. Инъекции как отдельных витаминов В1 В6 , В12 , так и их комбинации приводили к уменьшению тепловой гипералгезии в эксперименте с лигатурой седалищного нерва и компрессией спинального ганглия.
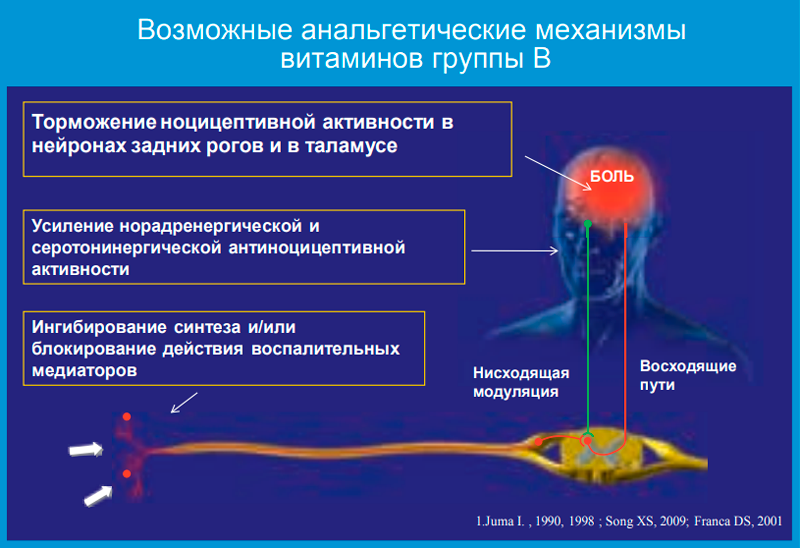
Витамины группы В в сочетании с дексаметазоном, а также витамин В12 усиливают обезболивающее действие при экспериментальной нейропатической боли. Показано ее уменьшение у крыс с экспериментальным диабетом. Есть доказательства синергичного эффекта в снижении тактильной аллодинии при одновременном применении витамина В12, бенфотиамина и антиконвульсанта карбамазепина или габапентина. Эти данные важны для понимания механизмов действия препаратов при их одновременном применении у пациентов с нейропатической болью. Полученные результаты экспериментальных работ в целом свидетельствуют о том, что витамины группы В обладают определенными анальгетическими свойствами.
При нормальном и разнообразном питании поступления витаминов в организм вполне достаточно, чтобы предотвратить какой-либо вита-минодефицит. Есть две группы нарушений, при которых витаминотерапия безоговорочно показана. Первая: витаминодефицитные состояния (бери-бери, пеллагра, алкоголизм, мальабсорбция, муковисцидоз и др.). Вторая: генетические дефекты метаболизма витаминов. При этом обе эти группы витаминодефицитных состояний составляют очень небольшую часть среди всех назначений витаминных препаратов. В практической деятельности витамины группы В чаще всего назначают как адъюванты при состояниях, не сопровождающихся дефицитом витаминов: болевые синдромы, психозы, алопеция, астения, туннельные синдромы. Очень часто при этом достигаются хорошие результаты лечения. С появлением синтетических витаминов стало возможным получить в одной дозе препарата то количество витаминов, которое человек получал бы с пищей в течение года. В этих фармакологических дозах витамины В1 В6 и В12 могут, вероятно, рассматриваться уже как «новые» лекарственные препараты. И возможно, что в таких дозах эти препараты приобретают новые свойства, в том числе, способность уменьшать боль.
В настоящее время продолжаются интересные экспериментальные исследования по применению витаминов в качестве активных лекарственных средств для лечения боли. Однако уже сегодня мы можем констатировать, что витамины группы В обладают определенными анальгетическими свойствами. В этом плане на первом месте стоит витамин В12, затем — В6 и B1. Комплекс B1 + В6 + В12 обладает более выраженным обезболивающим действием, чем монотерапия В1 В6, В12. При лечении острой боли в спине комбинация витаминов группы В с НПВП более эффективна и безопасна, чем монотерапия НПВП.
В мире ботулинотерапия активно применяется уже 30 лет, в России — около 15 лет. За эти годы был накоплен богатый клинический опыт, зарегистрировано несколько препаратов ботулинического токсина типа А (ботокс, диспорт, лантокс и ксеомин), проведены исследования и законодательно расширены показания к применению. Возможности использования ботулинического токсина чрезвычайно обширны: фокальные дистонии, спастичность ДЦП, гипергидроз, коррекция мимических морщин, косоглазие. При этом благодаря многочисленным исследованиям и накоплению доказательной базы список показаний постоянно увеличивается. Одним из новых направлений применения является использование препаратов ботулинического токсина типа А (БТА) в лечении болевых синдромов. История БТА для лечения боли началась в 1992 году, когда пластический хирург William Binder впервые обратил внимание на регресс головной боли у пациентов, которым вводился БТА с целью коррекции мимических морщин. Основная точка приложения БТА — пресинаптические терминали холинергических синапсов, в том числе нервно-мышечных, в результате чего он вызывает дозозависимую локальную мышечную релаксацию. И хотя БТА изначально использовался для заболеваний, проявляющихся повышенным мышечным тонусом, его аналгетический эффект был отмечен уже давно. Механизм аналгетического действия БТА при болевых синдромах остается не до конца ясным.
Обсуждаются такие возможные варианты анальгетического действия:
Выполнено более 50 клинических исследований (7500 пациентов), из них 28 рандомизированных, двойных слепых, плацебоконтролируемых исследований, продемонстрировавших эффективность БТА при различных формах головной боли напряжения и мигрени. Для лечения головной боли препараты ботулотоксина типа А обычно вводят в m. Procerus, билатерально в mm. Frontalis, Corrugator supercilii, Temporalis, Occipitalis и реже mm. Trapezius, Splenius capitis, Sternocleidomastoideus. Используют две методики:
Иногда используют комбинацию методик. Выбор методики зависит от жалоб пациента и данных врачебного осмотра. Методика «фиксированных точек» чаще применяется при мигрени, а методика «следуя за болью» — при головной боли напряжения и хронической мигрени. Оба подхода используют при смешанной головной боли. Препараты БТА разводят стерильным физиологическим раствором по стандартной методике. Его вводят шприцем с иглой диаметром 0,3 см. Для инъекций в область лица, головы и шеи лучше пользоваться шприцами с несъемными иглами. Общая доза БТА всегда определяется индивидуально и зависит от типа головной боли, тяжести симптомов, размеров тела, размеров областей инъекций (область головы или головы и шеи). Суммарная доза на одну процедуру для одного пациента варьирует от 1/3 до 2 флаконов препарата.
Это одна из самых частых форм вторичной головной боли. Инъекции производят в т. Splenius capitis, m. Semispinalis capitis, m. Levator scapulae, m. Trapezius с одной либо двух сторон в триггерные точки. Из побочных эффектов не исключено нарушение разгибания шеи при чрезмерном ослаблении затылочной группы мышц.
БТА безопасен и высокоэффективен в коррекции ГБ, связанной с краниоцервикальной дистонией, когда препарат вводят в дозах и по схемам, определяемым основным диагнозом — конкретной формой фокальной дистонии краниоцервикальной области.
У пациентов с резистентными к фармакологическому лечению различными видами невралгий показан положительный эффект от лечения БТА. При тригеминальной невралгии препарат вводили в больших дозах на стороне боли в область челюстной дуги (zygomatic arch); при постгерпетической невралгии — в зоне боли; при невралгии затылочного нерва — по методике аналгезирующих блокад. Дополнительное введение в традиционную лекарственную схему лечения инъекций БТА позволяет добиться положительной динамики и снизить тяжесть болевого синдрома.
При лечении МФБС инъекции производят в триггерные точки, определяемые путем пальпации, по анатомическим ориентирам, иногда с применением инструментального контроля (ЭМГ, УЗИ, КТ), что особенно важно для регионов со сложной анатомией (предплечье), при глубоком расположении мышц (грушевидная, подвздошно-поясничная), при риске развития побочных эффектов (близость к гортани, магистральным сосудам).
Пациентам, страдающим лицевой болью вследствие МФБС, БТА вводят в височные, жевательные, крыловидные мышцы, а также в мимические. Как правило, инъекции двусторонние, большую дозу вводят на стороне боли, однако дозировки необходимо рассчитывать с осторожностью, поскольку чрезмерное асимметричное ослабление жевательной мускулатуры может усугубить суставную дисфункцию и окклюзионные нарушения.
При нем в патологический процесс вовлечены m. Supraspinatus, т. Deltoideus, т. Subscapularis, т. Teres major. Инъекции БТА проводят в
Этим термином обозначают поражение мышц — разгибателей предплечья или латеральный эпикондилит, возникающие вследствие хронической травматизации при занятиях спортом. Рекомендуется однократное введение БТА в m. Extensor digitorum, что может значительно уменьшать болевые проявления более чем на трехмесячный период.
При мышечно-тонических болевых синдромах в поясничной области БТА вводят в грушевидную, подвздошно-поясничную, квадратную мышцу поясницы. Рекомендуется выполнять инъекции БТА в большом разведении (обычно в 4 мл физиологического раствора) и одновременно вводить до 8 мл анестетика.
При длительном сокращении мышц челюстей может развиться миофасциальная боль в жевательных мышцах и мышцах дна полости рта, стирание и разрушение зубов, дегенеративно-дистрофические изменения в височно-нижнечелюстном суставе, ограничение открывания рта. Для лечения БТА вводят билатерально в три мышцы: т.Temporalis, Masseter, Pterygoideus lateralis.
Описан положительный эффект при использовании инъекций БТА у женщин со спазмом мышц тазового дна и хронической тазовой неменструальной болью, резистентной к традиционной консервативной терапии.
В целом для лечения болевых синдромов инъекции БТА следует рассматривать в составе комплексной терапии, что позволяет расширить возможности традиционных лекарственных и нелекарственных методик. Результаты контролируемых клинических исследований и собственный опыт авторов показывают, что лечение БТА хорошо переносится пациентами, имея минимальные побочные эффекты. Инъекции БТА должен проводить квалифицированный врач, имеющий специальную подготовку и разрешение от фирмы-производителя.
Инъекции можно проводить амбулаторно в условиях процедурного кабинета. Использование БТА в лечении боли безусловно заслуживает внимания как один из эффективных и безопасных методов лечения.
Для лечения нейропатической боли при постгерпетической невралгии недавно был предложен пластырь с 8%-ным содержанием капсаицина (КУТЕНЗА). Капсаицин — острое, «жгучее» действующее вещество чилийского перца или капсикума (лат.«capsicum»).
Капсаицин — высокоселективный агонист TRPV1-рецепторов, представляющих собой лигандзависимые неселективные катионные каналы. Было установлено, что TRPV1-рецептор играет ключевую роль в передаче и модуляции болевых сигналов. Эти рецепторы экспрессируются в большом количестве на сенсорных нейронах малого диаметра, дающих начало популяции ноцицептивных сенсорных нервных волокон (С-волокна и Ad-волокна) в периферической нервной системе и в различных областях головного мозга. TRPV1 -рецепторы играют важную роль в передаче сигналов, вызванных повреждающими раздражениями (например, горячим), и передаче определенных веществ. Они сенсибилизируются медиаторами, ответственными за развитие боли в случае воспаления приповреждении тканей.
Экспрессия TRPV1 увеличивается при нейропатической боли, связанной с повреждением нервов, из-за ретроградного перемещения фактора роста нервов (ФРН) к телу клеток. Поскольку капсаицин — агонист TRPVl-рецепторов, предположение о его обезболивающем эффекте может показаться, на первый взгляд, нелогичным. Однако высокие дозы капсаицина при местном применении приводят сначала к возбуждению TRPV1-экспрессирующих сенсорных нейронов (возникает ощущение жара и жжения) и потом вызывают десензитизацию и даун-регуляцию (down-regulation), т.е. угнетение функции TRPVl-рецепторов. Следовательно, сенсорные аксоны небольшого диаметра становятся менее чувствительными к стимулам (в том числе к капсаицину), что приводит к уменьшению боли и аналгезии. Подобные эффекты капсаицина называют «дефункционализацией».
КУТЕНЗА представляет собой трансдермальную терапевтическую систему, содержащую 8% капсаицина.
Эта система позволяет быстро доставлять действующее вещество внутрь кожи пациента, к точке его приложения, и при этом не подвергать пациента и врача нежелательному системному воздействию активного вещества.
Каждая пленка размером 14×20 см содержит 179 мг капсаицина (640 мкг/см2 пленки). КУТЕНЗА состоит из однородной адгезивной пленки, которая обеспечивает эффективную доставку капсаицина через поверхностный слой кожи (рис. 1). Из пленки можно вырезать часть нужного размера и формы для наклеивания на определенный участок кожи. В упаковке КУТЕНЗЫ находится комплект из одной или двух отдельно запакованных пленок и тюбик с очищающим гелем 50 г (бутилгидроксианизол [Е320] 0,2 мг/г).

Препарат КУТЕНЗА показан для лечения периферической нейропатической боли у взрослых, не страдающих сахарным диабетом, в качестве монотерапии либо в сочетании с болеутоляющими препаратами.
Применение КУТЕНЗЫ должны осуществляться врачом или средним медицинским персоналом под контролем врача. Перед нанесением КУТЕНЗЫ пораженный участок следует обработать местными анестетиками (например, 4%-ным лидокаином) согласно инструкции производителя этого анестетика (рис. 2).
В зависимости от локализации наиболее болезненных участков одновременно можно использовать от одной до 4 пленок КУТЕНЗЫ. Данные клинических исследований показывают, что для достижения оптимального результата продолжительность экспозиции КУТЕНЗЫ должна составлять 30 минут при лечении нижних конечностей (стоп, например, при ВИЧ-AH) и 60 минут при аппликации на другие участки тела (например, при ПГН). После снятия пленки с капсаицином следует обильно нанести очищающий гель на место аппликации, чтобы удалить с кожи остатки капсаицина, и через 1 минуту стереть его сухим марлевым тампоном. Однократное 30- или
Вначале
Многочисленные клинические исследования свидетельствуют об эффективности триптанов у
У большинства больных оптимальной дозой для купирования приступа является одна таблетка препарата (50 мг суматриптана; 2,5 мг золмитриптана; 40 мг элетриптана). При возобновлении головной боли, но не ранее чем через 2 часа после первой дозы, возможно повторное применение суматриптана или золмитриптана. Суточная доза суматриптана должна быть не более 300 мг, золмитриптана — 15 мг. Для элетриптана эти рекомендации не подходят. Если применение 40 мг или 80 мг элетриптана не привело к уменьшению головной боли в течение 2 часов, то для купирования того же приступа не следует принимать вторую дозу, т.к. в клинических испытаниях эффективность такого лечения не доказана.
Однако при повторном приступе мигрени применение элетриптана может быть эффективным. Суточная доза элетриптана не должна превышать 160 мг. У
Бесспорно, опиоиды являются самыми действенными средствами для облегчения боли благодаря агонистическому воздействию на g-опиоидные рецепторы головного и спинного мозга. В спинном мозге, среднем мозге, в стволе мозга и в таламусе, а также в лимбической системе и в коре головного мозга находятся рецепторы-медиаторы, на которые могут влиять эндогенные и экзогенные опиоиды. Опиоиды представляют собой гетерогенную группу препаратов, которые издавна назначаются для лечения умеренной или сильной боли. Эти средства могут быть короткого или длительного действия; они выпускаются в виде разных лекарственных форм, включая препараты для перорального (быстрого или пролонгированного действия) и внутривенного применения, а также в виде пластырей (табл. 1).
| Класс | Препараты |
| Агонисты опиоидных рецепторов - действуют преимущественно на и-рецепторы |
Морфин* Меперидин* Гидроморфон Оксикодон Оксиморфон Метадон Леворфанол Фентанил Кодеин |
| Частичные агонисты опиоидных рецепторов - вызывают эффекты только частично в р-рецепторах |
Бупренорфин* |
| Агонисты-антагонисты опиоидных рецепторов вызывают эффекты в и- и k-рецепторах действуют как агонисты в рецепторах одного типа и как конкурентные антагонисты в рецепторах другого типа |
Буторфанол* Налбуфин* Пентазоцин |
| Антагонисты опиоидных рецепторов - блокируют нормальные эффекты опиоидных агонистов в рецепторе - применяются для купирования побочных эффектов опиоидов, таких, как угнетение дыхания и ЦНС |
Налоксон |
*Зарегистрированы в России
Опиоиды ценятся за их болеутоляющие свойства, но препараты этого класса вызывают в организме и другие эффекты. Опиоиды действуют на систему дыхания, сердечную деятельность, желудочно-кишечный тракт и мочевыводящую систему, вызывая потенциально опасные побочные эффекты. Обезболивание с помощью опиоидов также связано с проблемами толерантности к лекарственным препаратам и развития физической зависимости, а также с психологическими побочными эффектами. Выбор конкретного лекарственного препарата происходит от более слабого к более сильному средству в зависимости от клинической реакции. Очевидно, что увеличение дозы или мощности лекарства исходит из потребности контролировать боль, но это может быть связано и с устойчивостью к препарату. При боли, чувствительной к опиоидам, у пациентов обычно устанавливается плато на определенной дозе, повышать которую для контроля над болью не имеет смысла. Следовательно, если при изначальном исследовании реакции на нестероидные противовоспалительные средства выявляется плохой эффект, можно перейти к слабым опиоидам, например, к кодеину или трамадолу, а затем при необходимости к сильным опиоидам, таким, как морфин или оксикодон (табл. 2). Пластырь с фентанилом дает возможность ввести опиоид чрезкожно, что дает меньше побочных эффектов, чем при введении других опиоидов, он удобен для пациентов и снижает вероятность злоупотребления.
Таблица 2. Дозировки опиоидов и анальгетиков центрального действия (в сравнении с морфином)
| Препарат | Доза (мг), перорально | Доза (мг), в/м | Продолжительность действия (час.) |
| Морфин | 30 | 10 | 4 |
| Кодеин | 200 | 130 | 4-6 |
| Гидроморфон | 2-4 | 1-4 | 4-8 |
| Лево-дроморан | 2 | - | 6-8 |
| Оксикодон | 30 | 15 | 4 |
| Меперидин | 300 | 75 | 1-3 |
| Пентазоцин | 180 | 60 | 2-3 | Трамадол | 50-100 | - | 4-6 | Таргин | 5-40 | - | 8-12 |
| Специальные препараты опиоидов длительного действия для лечения хронической боли | |||
| Препарат | Доза (мг), перорально | Доза (мкг), подкожно | Продолжительность действия |
| Оксиконтин | 10-40 | - | 8-12 часов |
| МС Контин | 15-60 | - | 8-12 часов |
| Дюрогезик пластырь (фентанил) | - | 25-100 | 3 дня |
В основном опиоидные анальгетики используются в лечении онкологической боли. Правила их приема и рекомендации описаны в специальной литературе. Тем не менее при выраженной боли опиоиды применяются и при неонкологической боли. Предложено специальное руководство по их применению. Данные мета-анализов свидетельствуют, что в целом средства этой группы эффективны. Мнения о роли опиоидных анальгетиков в лечении нейропатической боли противоречивы. В результате недавно проведенного метаанализа были получены убедительные свидетельства эффективности этих препаратов. Среднее уменьшение интенсивности боли в исследованиях составило
Опасения, касающиеся угнетения дыхательной деятельности, также ограничивают применение опиоидов при хронической боли. Однако клинический опыт и исследования показывают, что боль физиологически противодействует угнетающему влиянию опиоидов на центральную нервную систему, в то время как у наркоманов или у здоровых добровольцев, не страдающих хронической болью, этот побочный эффект был достаточно выражен. Пациентам с хронической болью можно назначать мощные наркотические средства под тщательным медицинским наблюдением без риска угнетения дыхательной деятельности.
Побочные эффекты опиоидов необходимо тщательно отслеживать (табл. 3). Часто встречаются запор, тошнота, рвота. У пациентов пожилого возраста выше риск избыточного седативного воздействия, гипотензии и задержки мочи, но при тщательном мониторинге дозы и побочных эффектов можно эффективно управлять жалобами при хронической боли с помощью этих препаратов.
| ЦНС | Желудочно-кишечный тракт |
| Помрачение сознания Изменения настроения Сонливость Миоз Угнетение дыхательной функции Противокашлевое действие |
Запоры Боль в области живота Тошнота Рвота |
| Сердечно-сосудистая система | Прочие |
| Ортостатическая гипотензия | Задержка мочи Потливость, зуд, гиперемия Устойчивость, привыкание, синдром отмены |
Это препарат, обладающий низкой аффинностью к опиоидным g-рецепторам и одновременно являющийся ингибитором обратного захвата серотонина и норадреналина. В нескольких рандомизированных контролируемых исследованиях трамадол в дозе до 400 мг в день значительно уменьшал боль и повышал социальную и физическую активность.
Многие исследователи отмечают, что вероятность злоупотребления трамадолом намного ниже, чем опиоидами.
Трамадол вызывает такие побочные эффекты, как головокружение, тошнота, запор, сонливость и ортостатическая гипотензия. Для снижения вероятности развития побочных эффектов и наркотической зависимости применение трамадола следует начинать с низких доз (50 мг 1 или 2 раза в день) и затем титровать каждые
Оксикодон+налоксон (Таргин) в таблетках продленного действия применяется для терапии умеренной и сильной боли. При умеренной боли назначается в дозе от 5 до 20 мг оксикодона в сутки, при сильной боли дозы начинаются от 30-40мг в сутки.
Препарат содержит два опиоидных препарата: оксикодона гидрохлорид — агонист мю-опиоидных рецепторов и налоксон — антагонист опиоидных рецепторов. Оксикодон после приема внутрь имеет высокую абсолютную биодоступность (87%), около 45% связывается с белками плазмы, оказывает выраженное анальгетическое действие; метаболизируется в кишечнике и печени с образованием активных метаболитов при участии системы цитохрома Р450, которые выводятся почками и кишечником. Налоксона гидрохлорид при приеме внутрь практически не всасывается (биодоступность — менее 3%); метаболизируется в печени; выводится почками. Благодаря локальному конкурентному воздействию на опиоидные рецепторы в кишечнике, налоксон уменьшает выраженность нарушений функций кишечника, типичных при лечении опиоидами (тошнота, запоры).
Разовые дозы препарата оксикодон+налоксон для терапии сильной боли 10 мг/ 5; мг 20 мг/10 мг; 40 мг/ 20 мг. Пациентам, которые принимали опиоиды ранее, могут потребоваться более высокие дозы в зависимости от длительности предыдущей терапии.
Доза препарата 5 мг/2,5 мг предназначена для подбора суточной дозы в начале лечения с учетом индивидуальной чувствительности пациента. Максимальная суточная доза препарата не должна превышать 80 мг оксикодона гидрохлорида и 40 мг налоксона гидрохлорида.
Интерес к этой группе препаратов как к потенциальным анальгетикам обусловлен их противовоспалительными свойствами и безопасностью применения. Хорошо изучена эффективность этих средств в лечении патологии суставов, тогда как в терапии хронической боли в спине они используются значительно реже. В специальных работах показано, что такие компоненты хондропротекторы препаратов, как глюкозамин и хондроитин, в больших дозах обладают определенными противовоспалительными эффектами и уменьшают боль независимо от структурно-модифицирущего эффекта. Отличительные особенности этих препаратов — время наступления эффекта, обычно спустя 2 — 8 недель от начала лечения, и сохранение эффекта в течение 2 — 3 месяцев после прекращения терапии. В механизме противовоспалительного и обезболивающего действия хондроитин сульфата и глюкозамина, по-видимому, играют роль многие факторы. В частности, показано, что хондроитин сульфат влияет на клеточный компонент воспаления. Установлено, что хондроитин сульфат дозозависимым образом подавляет стимулированный ИЛ-1 синтез коллагеназы. В экспериментальных исследованиях хондроитин сульфат в низких дозах приводил к уменьшению признаков воспаления в суставах, подавлению синтеза антител к коллагену, а в высоких (1000 мг/кг) — к подавлению деструкции хряща. Противовоспалительный и анальгетический эффекты хондроитина обусловлены влиянием на цитокины (ингибирует
Для всех хондропротекторов Е.Л.Насонов отмечает следующие общие черты:
Сравнительно новый препарат из группы хондропротекторов — пиаскледин, действующим началом которого являются неомыляющиеся соединения, полученные с помощью особой технологии из экстрактов сои и авокадо. Механизм их действия заключается в способности ингибировать ряд провоспалительных цитокинов, в частности, ИЛ-Iβ, ИЛ-6, ИЛ-8, металлопротеиназ (коллагеназы, стромелизина), а также увеличивать экспрессию ТФР-β1, оказывающего анаболическое влияние на суставной хрящ.
В последние годы опубликовано несколько исследований об эффективности инъекционного препарата Алфлутоп при остеоартрозе и болях в спине. Алфлутоп — оригинальный инъекционный препарат, представляющий собой экстракт из морских рыб, который содержит гликозаминогликаны, в том числе гиалуроновую кислоту, хондроитина сульфат, дерматан сульфат, кератан сульфат. Препарат обладает хондропротекторным и противовоспалительным эффектом, регулирует обмен веществ в хрящевой ткани. Его хондропротекторное действие связано с угнетением активности гиалуронидазы и других ферментов, которые принимают участие в разрушении межклеточного матрикса и нормализации биосинтеза гиалуроновой кислоты и коллагена II типа. Алфлутоп тормозит биосинтез медиаторов воспаления, снижает проницаемость капилляров. Протеогликаны, входящие в его состав, оказывают трофическое действие и обладают замещающим эффектом, достоверно увеличивая показатели магнитно-резонансной томографии (МРТ), гидрофильности, высоты хряща и однородности костной ткани.
На основании двойного слепого плацебоконтролируемого исследования 90 пациентов с остоартрозом коленного сустава, помимо симптом-модифицирующего действия, доказан структурно-модифицирующий эффект: он замедляет рентгенологическое прогрессирование ОА коленных суставов и уменьшает деградацию матрикса суставного хряща.
Весьма интригующим является анальгезирующее действие препарата, которое, по данным многих авторов, проявляется довольно быстро. В открытом многоцентровом исследовании по оценке эффективности и безопасности препарат алфлутоп у пациентов с вертеброгенной цервикобрахиалгией продемонстрирована его способность снижать выраженность болевого синдрома, увеличивать подвижность в шейном отделе позвоночника и плечевом суставе [6].
В целом положительный результат отмечен у 82% больных, при этом обезболивающий эффект проявился уже в течение первых 2 недель после начала лечения. В специальном двойном слепом плацебо-контролируемом исследовании по применению препарата алфлутоп при хронической люмбоишиалгии также была выявлена его высокая эффективность. В этих и других работах по применению препарата Алфлутоп отчетливо продемонстрировано, что наступление обезболивающего эффекта начинается на
В специальной работе изучались механизмы обезболивающего эффекта препарата алфлутоп в лечении пациентов с хронической болью в спине. В исследовании приняли участие 30 пациентов. Проводилась монотерапия препаратом алфлутоп по 1 мл внутримышечно ежедневно в течение 20 дней. За 3 дня до начала исследования в соответствии с протоколом предшествующая фармакотерапия боли прекращалась. Во время лечения не использовались физиотерапия, массаж и мануальная терапия. Курс лечения препаратом Алфлутоп на протяжении 3 недель (по одной внутримышечной инъекции ежедневно) привел к достоверному снижению интенсивности болевого синдрома в исследуемой группе пациентов. Уменьшение боли отмечалось со
Нуклеотиды играют ключевую роль в процессе регенерации поврежденного периферического нерва. Как нуклеотиды, так и витамины, повышают синтез фосфолипидов, гликолипидов и белков, основных компонентов мембраны нейронов. Кроме того, нуклеотиды, а точнее уридин, выступают в качестве эндогенного сигнала к индукции быстрого заживления раны в случае повреждения периферического нерва.
Нуклеотиды — это низкомолекулярные структурные элементы. Они играют фундаментальную роль в процессах метаболизма. Участвуют в процессе сохранения энергии или помогают в переносе определенных групп молекул, выступают в качестве внутриклеточных сигнальных молекул. Кроме того, являются важными компонентами нуклеиновых кислот, в частности ДНК и РНК. Главнейшая биохимическая составляющая нуклеотидов — нуклеиновые основания, формированные кольцевыми структурами, которые в свою очередь образованы углеродом, азотом, производными пиримидина или пурина. К наиболее важным для построения нуклеотидов пиримидиновым основаниям относятся урацил, цитозин, тимин, а пуриновым — аденин и гуанин. Кроме нуклеинового основания в состав нуклеотидов входит еще два компонента: молекула сахара и фосфатная группа. Каковы источники поступления нуклеотидов? Они могут синтезироваться некоторыми клетками организма человека, однако нервные клетки не имеют энергетических ресурсов для синтеза нуклеотидов, соответственно зависят от поступления пиримидиновых нуклеотидов извне, в особенности от экзогенного обеспечения уридинмонофосфатом. Существует два пути обеспечения нервных клеток этим субстратом. Первый — клетки тканей организма высвобождают в кровеносное русло часть образованного ими уридина. Второй — организм поглощает уридинмонофосфат из внешних источников с пищей. В обоих случаях нуклеотид попадает в кровеносное русло и транспортируете! с током крови в нервные клетки. Что касается биохимической функции нуклеотидов, то пиримидиновые нуклеотиды уридин и цитидин являются компонентами информационной, транспортной и рибосомной РНК. Через них регулируется биосинтез белка, в том числе ферментов. Они поддерживают адекватную поставку ферментов в нервные клетки и тем самым способствуют более быстрой репарации поврежденных нервов.
Пиримидиновые нуклеотиды выступают в роли коферментов (активаторов ферментных процессов), эффективно стимулируют синтез фосфо- и гликолипидов (или сфинголипидов), а также гликопротеинов. Эти молекулы — незаменимые структурные компоненты клеточных мембран, особенно в клетках нервной ткани. Следует отметить те необходимые для осуществления нейрорегенерации биохимические процессы, в которых нуклеотиды принимают самое активное участие:
Нуклеотид уридинмонофосфат (состоит из урацила, моносахарида и фосфатной группы) — важнейший в метаболизме нервной ткани нуклеотид. Он играет центральную роль в синтезе в клетках нервной ткани всех остальных необходимых пиримидиновых нуклеотидов. Проникая через мембрану внутрь нервной клетки, нуклеозид быстро переходит в ди- и в трифосфат-нуклеотиды, которые обладают еще более выраженным метаболическим действием в отношении репарации нервной ткани. Таким образом, путем биохимических процессов поступивший извне в организм уридинмонофосфат метаболизируется до дальнейших нуклеотидов, которые также включаются в метаболизм и репаративные процессы.
Механизм действия уридина носит многофакторный характер и включает регенерацию и профилактику дальнейшей дегенерации периферической нервной системы. Его влияние можно разделить на две основные категории: внутри- и внеклеточное. Хорошо известно, что только нуклеозиды (цитидин, уридин), но не нуклеотиды (их фосфорилированные формы), могут проникать через биологические мембраны. После проникновения внутрь нервной клетки часть уридина подвергается аминированию с образованием цитидина (Wurtman et al., 2000). Оставшийся уридин и вновь образованный цитидин становятся основополагающими компонентами ДНК и РНК, увеличивая активность процессов транскрипции и трансляции. Им также при надлежит важная ферментная функция в биосинтезе таких мембранных компонентов, как фосфолипиды, гликолипиды и гликопротеины.
Данные компоненты обнаруживаются в высоких концентрациях в периферических нервах и играют принципиальную роль в образовании и созревании аксонов и миелиновой оболочки (Wattig et al., 1992). В дополнение к их внутриклеточному действию, пиримидиновые нуклеотиды, в частности УТФ и УДФ, оказывают также влияние на нервную систему, активируя мембранные рецепторы P2Y в мембранах нейронов. Как показали недавние фундаментальные исследования, данная активация стимулирует пролиферацию шванновских клеток, миграцию и адгезию к аксону поврежденного нерва (Martianez et al, 2012; Martianez et al, 2013; Lamarca et al, 2014) (Рисунок 1).
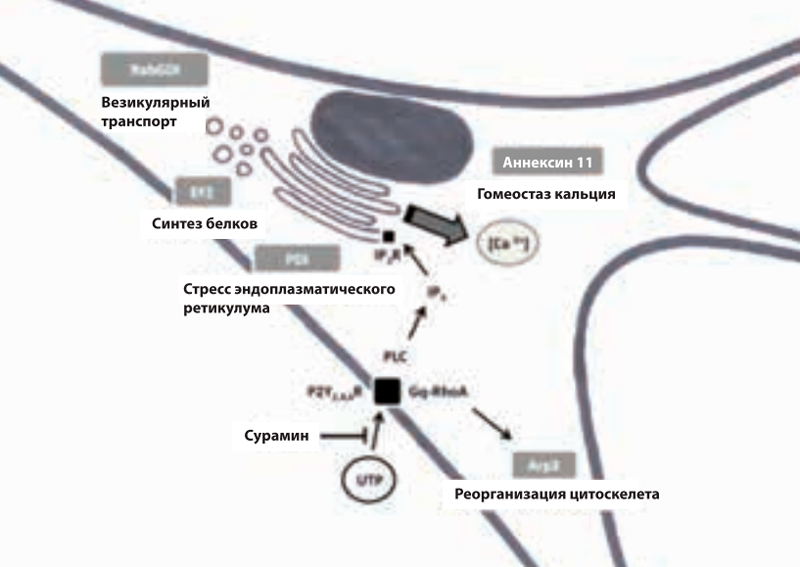
Уридинмонофосфат (50 мг) — основной компонент новинки отечественного фармацевтического рынка Келтикана комплекса. Помимо нуклеотида в состав Келтикана комплекса входят также витамин В12 (3 мкг) и фолиевая кислота (400 мкг). Витамин В12 — необходимый кофермент различных метаболических реакций. Он вовлечен в этапы синтеза пуриновых и пиримидиновых нуклеиновых оснований, нуклеиновых кислот и белков. Фолиевая кислота выступает в качестве кофермента во множестве реакций, в особенности в метаболизме белка и нуклеиновых кислот, в частности вовлечена в синтез пурина, ДНК, сборку и разборку различных аминокислот. Участвует в биосинтезе нейротрансмиттеров, фосфолипидов, гемоглобина. Таким образом, Келтикан® комплекс — это внешний источник элементов, необходимых для репарации нервной ткани. Келтикан® комплекс способствует регенерации нерва, восполняя повышенную потребность нервной ткани в синтезе или утилизации липидов и протеинов. Содержащийся в нем уридинмонофосфат активирует процессы транскрипции и трансляции в клетках нервной ткани (синтез ДНК/РНК). В результате этого стимулируются деление клеток, метаболизм, регенерация периферических нервов. Кроме того, уридинмонофосфат играет ключевую роль в процессе активации внутри- и внеклеточных сигналов, руководящих комплексным процессом миграции/адгезии шванновских клеток к аксону. Комплекс нуклеотидов изучался в условиях эксперимента и продемонстрировал достоверное влияние на структуру нервной ткани.
В многочисленных клинических исследованиях была показана эффективность нуклеотидов (уридин, цитидин) при различных метаболических (диабетической, алкогольной) полиневропатиях, костно-суставных (т.е. при межпозвонковых радикулопатиях) и инфекционных (вирусных) поражениях нервов. Также проводилась оценка эффективности пиримидиновых нуклеотидов в лечении люмбаго и невралгий, затрагивающих тройничный, лицевой и межреберный нервы. Следует иметь ввиду, что подавляющее большинство данных исследований было проведено с препаратами, содержащими комбинацию уридина и цитидина (Нуклео ЦМФ форте, разработанный компанией Grupo Ferrer Internacional, S.A), некоторые из них — с препаратами, содержащими только УТФ или УМФ, в остальных использовалась комбинация УМФ с витамином В12 и фолиевой кислотой (Келтикан комплекс, Trommsdorff Gmbh & Со., Германия, Grupo Ferrer Internacional, S.A.).
Несмотря на различную степень фосфорилирования уридина или цитидина в их составе, эффективность всех препаратов базируется главным образом на наличии и количестве уридина в соответствующих лекарственных формах, поскольку экзогенные нуклеотиды быстро дефосфорилируются после приема внутрь, т.е. УТФ, УДФ и УМФ, а также цитидин быстро превращаются в уридин, который обладает разнообразными функциями в нервной системе. С другой стороны, витамин В12 и фолиевая кислота усиливают действие уридина.
В двойном слепом исследовании, включавшем 303 пациента, получавших ЦМФ по 2,5 мг и УМФ/УДФ/УТФ по 1,5 мг три раза в сутки, данная комбинация значительно облегчала сенсорные и сенсомоторные нарушения, связанные с алкогольной полинейропатией, через 3 недели лечения (Kretschmar et al., 1996). В данном исследовании активный препарат был также эффективен, как два препарата сравнения, содержащих комбинации витаминов группы В. Боль и парестезия оценивались по визуальной аналоговой шкале (ВАШ) длиной 10 см с точки зрения распространения, интенсивности и продолжительности. Полученные по ВАШ суммарные оценки были первичными критериями эффективности. Сенсорные параметры (прикосновение, холодная температура, физиологическая боль), проприоцепция большого пальца стопы, а также сила дорсифлексии и подошвенных сгибателей стопы оценивались в качестве вторичных критериев. Улучшение суммарных оценок по ВАШ более чем на 50% было выявлено у 64% пациентов, получавших исследуемый препарат, и у 61% пациентов и 60,2% пациентов, получавших два препарата сравнения. Все вторичные параметры эффективности улучшались на фоне всех трех видов терапии. Четкое свидетельство пользы уридина в качестве этиотропного лечения диабетической полинейропатии было получено в двойном слепом плацебо-контролируемом исследовании электромиографии (Gallai et al., 1999). Двадцать пациентов с диабетической полинейропатией получали внутрь уридин (300 мг три раза в сутки) в течение 180 дней, в то время как другие 20 пациентов получали плацебо. Критериями включения были: патологическое снижение скорости проведения импульсов не менее чем в двух периферических двигательных и чувствительных нервах с доминирующей стороны, хроническая боль в нижних конечностях и снижение вибрационной чувствительности.
Не обнаружено статистически значимого улучшения в группе плацебо. В группе уридина пациенты показали значительное повышение скорости проведения нервных импульсов через 120 и 180 дней по сравнению с исходными показателями. Через 90 дней после окончания лечения было проведено контрольное обследование, которое показало, что в течение периода наблюдения улучшения сохранялись.
В открытом исследовании 15 пациентов с диабетической полинейропатией получали внутривенные инфузии ЦМФ в дозе 15 мг и УМФ/УДФ/УТФ в дозе 5,6 мг один раз в сутки в течение 5 дней. Первичными конечными точками по эффективности были боль (оцениваемая по ВАШ), общее клиническое впечатление и показатели оценки симптомов нейропатии. Вторичными конечными точками были рефлекторная реакция, глубокая и поверхностная чувствительность, чувство положения пальцев стопы, сила мышц голени и скорость проведения нервного импульса. На 6 день отмечено значительное уменьшение (р<0,001) боли и профиля симптомов нейропатии. Общее клиническое впечатление улучшилось у 47% пациентов. Наконец, не отмечено изменений со стороны вторичных конечных точек (Kramer et al., 1991).
Эффективность пиримидиновых нуклеотидов при диабетической полинейропатии также оценивалась в ходе открытого исследования,включавшего 40 пациентов, получавших внутрь ЦМФ в дозе 5 мг и УМФ/УДФ/УТФ в дозе 3 мг два раза в сутки в течение 3 месяцев. Критериями эффективности были улучшение показателей нейропатической нетрудоспособности, скорости проведения импульсов по чувствительным и двигательным нервам и восприятие боли по ВАШ. Применение пиримидиновых нуклеотидов приводило к значительно более хорошим (р<0,05) оценкам выраженности боли и показателям проводимости чувствительных нервов по окончании лечения (Muller, 2002).
В другом открытом исследовании с участием 50 пациентов с тем же самым состоянием, пациенты получали комбинацию уридина и цитидина в виде внутримышечных инъекций один раз в сутки в течение 10 дней, вслед за чем следовал прием 2 капсул два раза в сутки в течение 14 дней. Контрольную группу составили 10 пациентов на стандартной терапии.
Эффективность оценивалась по изменениям порога чувствительности к боли, температуре, прикосновению и вибрации, а также по данным электромиографии. Терапия приводила к уменьшению всех порогов чувствительности и функции периферических нервов, что стало очевидным через 2 недели. Значимое улучшение параметров чувствительности и проводимости двигательных и чувствительных нервов наблюдалось уже на 15 день лечения, в сравнении с группой контроля (Pankiv, 2008). В группе контроля эти изменения были незначительными.
В открытом проспективном исследовании изучалось внутримышечное введение ЦМФ в дозе 10 мг + УТФ в дозе 6 мг + витамин В12 в дозе 4 мг один раз в сутки у 425 пациентов с шейной, спинной и поясничной радикулопатией, или ишиасе. Через 9 дней пациенты были переведены на прием внутрь ЦМФ 15 мг + УТФ 9 мг + Витамина В12 6 мг 3 раза в сутки в течение 21 дня. Некоторые из включенных в исследование пациентов были детьми (с 13 лет), но для этой категории пациентов не было описано изменение дозы. Эффективность оценивалась по улучшению показателей боли в покое, боли при активном и пассивном движении, боли при пальпации и функциональной способности. К окончанию периода лечения у 82,9% пациентов отсутствовали боли в покое, в сравнении с 9,5% до начала терапии (р<0,0001). Частота тяжелых болей в покое снизилась с 24,5% на момент начала лечения до 0,8% к окончанию терапии. Полноценная функциональная способность пораженной конечности или болезненного отдела отмечалась у 9,8% пациентов до лечения, к концу лечения этот показатель увеличился до 56,9% (р<0,0001) (De Mora и Monfort, 1991).
В открытом рандомизированном сравнительном исследовании применение у 50 пациентов с дискогенной радикулопатией ЦМФ в дозе 2,5 мг + УМФ/УДФ/УТФ в дозе 1,5 мг + Витамина В12 в дозе 1 мг два раза в сутки через 12 недель значительно превосходило лечение комплексным препаратом витаминов группы В. Критериями оценки были подвижность, оценивавшаяся по пространству между кончиками пальцев и полом, результаты тестов Шобера и Ласега, а также интенсивность боли исходно и через 3 и 12 недель. Через 12 недель расстояние между пальцами и полом, а также результаты тестов значительно улучшились по сравнению с исходными показателями на фоне обоих лекарственных средств (р<0,001). Исследуемый препарат значительно превосходил комбинацию витаминов группы В по показателю расстояния между пальцами и полом (р—0,0156), но по результатам тестов разницы между видами лечения не обнаружено.
К окончанию периода наблюдения 11/25 пациентов, получавших исследуемый препарат, и 2/25 пациентов, получавших препарат сравнения, не имели боли (р<0,0001) (Klein, 1990).
В третьем открытом исследовании оценивался эффект перорального применения УМФ в дозе 50 мг + витамина В12 в дозе 0,003 мг + фолиевой кислоты в дозе 0,4 мг (Келтикан комплекс) один раз в сутки в течение 3 недель в качестве вспомогательной терапии к стандартному лечению у 83 пациентов с болью, особенно в поясничном отделе позвоночника, и ограничением подвижности после хирургической коррекции поясничной межпозвоночной грыжи. Группу контроля составили 40 пациентов, получавших только стандартную терапию (физиотерапия, анальгетики, физиотерапия и бальнеологическое лечение). Первичным и вторичным критериями эффективности были: интенсивность боли по данным ВАШ и качество жизни, которое оценивалось по стандартному опроснику (QLQ-C30), соответственно. Более выраженное снижение восприятия боли было зарегистрировано в активной группе (ВАШ: 90, 24 и 8 исходно, через 14 дней и три недели, соответственно), по сравнению с группой контроля (ВАШ: 81,44,5 и 30 пунктов исходно, через 14 дней и три недели, соответственно. Эти отличия были статистически значимыми и соответствуют 91% уменьшению боли в группе контроля и 60% в группе контроля. На фоне исследуемого препарата также значительно (р<0,001) улучшилось качество жизни участников исследования к окончанию терапии, в сравнении с контрольной группой. Оценка по Шкале общего клинического впечатления, которая отражает общее состояние здоровья, значительно улучшилась у 89% пациентов в группе исследуемого препарата, и лишь у 40% пациентов контрольной группы. Также отмечались значительные изменения различных вторичных клинических показателей, например нарушения чувствительности, миогелоз и парез (Larm et al., 2008).
В ретроспективном исследовании оценивался эффект комплекса цитидин-уридин-витамин В12 в качестве вспомогательного средства при ведении хронической нейропатической поясничной боли у пациентов с каудальным введением клонидина, лидокаина и дексамета зона. На протяжении того периода спинальная блокада с введением лидокаина, клонидина и дексаметазона проводилась три раза всем пациентам (48 пациентов). В ходе исследования 21 пациент был направлен на проведение каудальной блокады (контрольная группа, КГ), 21 пациент получал внутрь комплекс цитидин-уридин-витамин В12 два раза в сутки в течение 28 дней (исследуемая группа, ИГ).
Первичной конечной точкой была разница в снижении боли между группами по данным ВАШ. Результаты показали, что в то время как интенсивность боли (ВАШ (см)) в 1 день была одинаковой в двух группах (КГ — 8,3±1,4; ИГ — 8,6±1,1; р=0,5485), со временем результаты в исследуемой группе стали лучше, а именно: ВАШ на 14 день: КГ — 3,9±1,2; ИГ — 2,3±1 (р=0,00003); ВАШ на 28 день: КГ — 2,8±0,7; ИГ −1,9±0,9 (р=0,0011) и ВАШ на 56 день: КГ — 2,3±1,2; ИГ −1,7± 1,1 (р=0,07). Потребность в пероральном приеме кетопрофена (использовался в качестве резервного препарата) была выше в первые 14 дней лечения в КГ (р=0,0002), что свидетельствует об эффективности применения данной комбинации при нейропатических болях (Lauretti et al., 2005).
Четкое свидетельство анальгетического эффекта уридина было получено в двойном слепом рандомизированном плацебо-контро-лируемом исследовании, оценивавшем эффективность УМФ при остром люмбаго. Было включено 80 пациентов, 40 из них получали суточную дозу УМФ 19,35 мг в течение 4 дней в виде внутривенных инфузий. Первичной конечной точкой было изменение боли, возникающей во время движения, через 24 часа после первого введения. Вторичными показателями были боль в покое, субъективная оценка подвижности, подвижность спины и наличие и тяжесть миогелоза. После первой инфузии боль при движениях уменьшилась более значительно (р=0,025) на фоне УМФ, чем на фоне плацебо. Отмечалось улучшение по всем вторичным показателям эффективности, хотя значимо — только в отношении субъективной оценки подвижности (р<0,05), в сравнении с плацебо (Liebau et al., 2003).
Было проведено открытое исследование с участием 30 пациентов с острой нейропатии лицевого нерва, сопровождавшимся умеренной или тяжелой острой или хронической болью. В течение первой недели лечения пациентам проводились внутримышечные инъекции ЦМФ в дозе 5 мг + уридина фосфата в дозе 3 мг + витамина В12 в дозе 2 мг один раз в сутки. В течение второй недели лечения такая же доза вводилась два раза в сутки перорально. Клинически значимое улучшение наблюдалось у пациентов с незначительными количественными нарушениями, а также у пациентов с легкими и умеренными дегенеративными признаками.
К окончанию лечения 22/30 (55%) пациентов не имели боли. Первое снижение боли было выявлено на Зй день лечения у пациентов с острой болью (р<0,05) и на 7й день лечения у пациентов с хронической болью (р<0,05) (Sturm, 1988).
Исследование, включавшее более 2000 пациентов с диагностированной нейропатией различной этиологии, которых лечили пиримидиновыми нуклеотидами перорально и/или парентерально, показало, что 89% пациентов сообщили о положительных результатах лечения (Hedding-Eckerich, 2001). Наиболее частой причиной нейропатии были болевые вертебральные синдромы (26% всех пациентов имели поясничную радикулопатию). Другими причинами были: метаболические полинейропатии (10% с диабетической и 3,5% с алкогольной нейропатией) и состояния, поражающие один периферический нерв, например, невралгия тройничного нерва, постгерпетическая, межреберная невралгия и невралгия лицевого нерва. Сорок процентов пациентов получало сопутствующую терапию, чаще всего анальгетики и нестероидные противовоспалительные препараты.
Лекарственный препарат назначался следующим образом: 45% пациентов получали его только перорально, 10% только парентерально (чаще всего внутримышечно), в остальных случаях применялся комбинированный путь. Перорально использовалось
Другими словами, хотя в исследовании не представлено доказательство статистически значимых преимуществ применения нуклеотидов в лечении нейропатий, результаты показывают клинически значимую пользу, что задокументировано большинством пациентов и врачей различных специальностей (Рисунок 2).
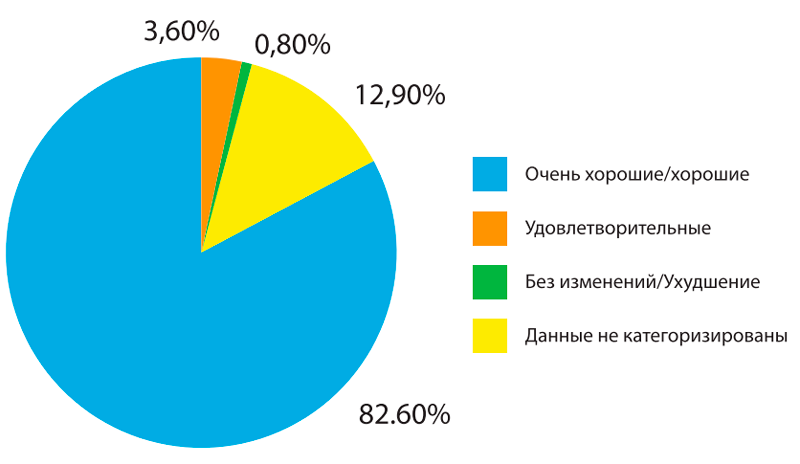
В другом открытом проспективном исследовании оценивался эффект пиримидиновых нуклеотидов у госпитализированных пациентов с сенсомоторными полинейропатиями (тетрапарез, парапарез и снижением чувствительности). В большинстве случаев (80%) состояние было идиопатическим. Применение ЦМФ в дозе 2,5 мг, УМФ/УДФ/УТФ в дозе 1,5 мг и витамина В12 в дозе 1 мг 3 раза в сутки приводило к клинически значимому увеличению силы мышц (оценивалась с помощью ортопедического динамометра) в течение
Наконец, эффективность применения препарата Келтикан комплекс® (комбинированный препарат, содержащий УМФ (50 мт), витамин В12 (3 мкг) и фолиевую кислоту (400 мкг)) у 212 пациентов с различными нейропатиями оценивалась в ходе открытого поискового проспективного многоцентрового исследования, проведенного в 76 центрах первичной медицинской помощи в Португалии. Врачи были свободны оставить пациента на его обычной терапии и дополнительно назначить ежедневный прием 1 капсулы препарата Келтикан комплекс в течение 60 дней. Клиническая оценка проводилась при включении и через 60 дней после начала исследования. Основным критерием эффективности была оценка боли с помощью валидированного опросника для оценки боли (PDQ) до начала исследования и по его окончании. Данный опросник оценивает боль по трем показателям: интенсивность боли в настоящий момент, наиболее интенсивная боль в течение последних недель и средняя интенсивность боли в течение последних 4 недель. Данные показатели оценивались по шкале от 1 (боли нет) до 10 (максимальная боль). Проводилась оценка количества принимаемых лекарственных препаратов на момент начала и окончания исследования с целью выявления какого-либо снижения их применения.
Результаты показали, что в то время, как средняя исходная интенсивность боли была равна 6,6±2,0, на 60 день она ощущалась на 3,7±1,8 (р< 0,001). Исходная интенсивность самой сильной боли в течение последних недель составила 7,6±1,8, а через 60 дней снизилась до 4,7±1,9 (р<0,001). Что касается интенсивности боли в течение последних 4 недель, исходная средняя интенсивность боли составила 6,5±1,9, а через 60 дней терапии снизилась до 3,9±1,7. Общая средняя оценка по PDQ на исходном визите составила 17,5±5,7 пунктов. На 60 день оценка показала, что общее среднее значение снизилось до 8,8±5,2 пунктов (р<0,001) (рисунок 2). Что касается применения сопутствующих лекарственных препаратов, к моменту финального визита оно снизилось у большинства пациентов (75,6%) по сравнению с исходным показателем.
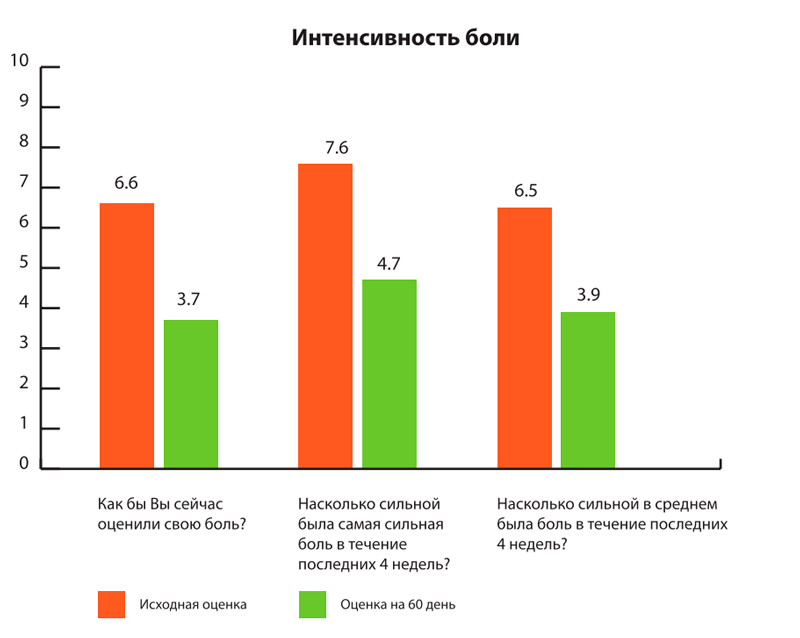
Безопасность уридина (в комбинации с витаминами или без них) была продемонстрирована в ходе его широкого применения во всем мире у огромного количества пациентов. В рассмотренных исследованиях не сообщалось о смертях или серьезных нежелательных эффектах. Эти данные не вызывают удивления, поскольку эти компоненты являются органическими соединениями. Низкая частота возникновения и небольшая тяжесть зарегистрированных нежелательных лекарственных реакций свидетельствуют об отличном профиле безопасности препарата.
Эффективность применения уридина при различных нейропатиях была широко продемонстрирована. Эго эффекты можно усилить путем добавления витамина В12 и фолиевой кислоты. В ряде клинических исследований показан значимое снижение связанных с болью симптомов, улучшение качества жизни и уменьшение потребности в применении сопутствующих препаратов.
Профиль безопасности данных средств и низкий риск лекарственного взаимодействия свидетельствуют в пользу их применения у пациентов с периферическими нейропатиями, вне зависимости от их причин.